
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.
4 5 6
12 13
B.
2
8
16 17 18
C.
1 2
11
19
D.
4
10 11 12
20
考点: 元素周期表的结构及其应用.
分析: 根据元素周期表的结构:相邻两个周期同主族元素的原子序数相差2、8、18、32,以此判断同族中位置关系;同周期元素根据原子序数判断位置关系,据此来分析,注意第三列镧系、锕系,长周期第ⅡA族、第ⅢA族之间有10个空列为7个副族和1个Ⅷ族.
解答: 解:A.4和5,12和13间有10个空列为7个副族和1个Ⅷ族,且与5号同主族相邻的下一周期原子序数为13,与6号同主族相邻的下一周期原子序数为14,故A错误;
B.最前列为ⅥA族,最小行为16、17、18,最后列为零族,第一、三周期的原子序数为2、18,符合位置关系,故B正确;
C.1号和11号元素之间相隔一个周期,第一列应为1、3、11、19,2号元素与1号元素之间相隔16列,故C错误;
D.10号元素与4号元素处于同一周期,故D错误.
故选:B.
点评: 考查运用原子序数推导元素在周期表中的位置关系,难度中等,关键清楚元素周期表的结构.


科目:高中化学 来源: 题型:
在氧化还原化学反应中(2CuO+C 2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸,再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为( )
|
| A. | 0.1 mol |
|
| B. | 大于或等于0.2 mol且小于0.3 mol |
|
| C. | 等于0.2 mol |
|
| D. | 大于0.1 mol且小于0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上常用燃烧法确定有机物的组成.如图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成.
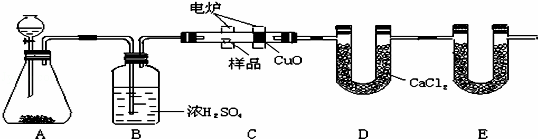
回答下列问题:
(1)装置A中装有MnO2,写出A装置中发生反应的化学方程式是 ;
(2)C装置(燃烧管)中CuO的作用是 ;
(3)写出E装置中所盛放物质的名称 ,它的作用是 .
(4)若将B装置去掉会对实验结果造成什么影响? .
(5)若准确称取1.20g样品(烃或烃的含氧衍生物).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的实验式为 .
(6)从定量测定准确角度去考虑,该装置应怎样进一步改进 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42﹣向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu﹣2e﹣═Cu2+,发生氧化反应.
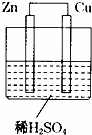
A. ①②③ B. ②④ C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
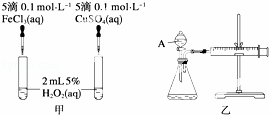
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
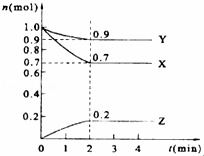
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为 .
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为 .
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n始:n平= 10 .
(4)达到平衡时,X和Y的转化率之比,α(X):α(Y)= .
(5)平衡时,Z的体积分数为 (保留两位有效数字).
(6)反应达到平衡后,下列措施能加快化学反应速率的有 (填序号,多选或少选无分).
A.增大反应物的浓度 B.升高温度 C.使用正催化剂
(7)下列叙述能说明上述反应达到平衡状态的是 (填序号,多选或少选无分).
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是( )
|
| A. | v(O2)=0.01mol•(L•s)﹣1 | B. | v(NO)=0.008mol•(L•s)﹣1 |
|
| C. | v(H2O)=0.003mol•(L•s)﹣1 | D. | v(NH3)=0.02mol•(L•s)﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com