
| ��� | HCOOCH3 | H2O | HCOOH | CH3OH |
| ���ʵ���/mol | 1.00 | 1.99 | 0.01 | 0.52 |

| ��Ӧʱ�䷶Χ/min | 0��5 | 10��15 | 20��25 | 30��35 | 40��45 | 50��55 | 75��80 |
| ƽ����Ӧ����/��10-1mol?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
| ��n |
| ��t |
| 0.045 |
| 5 |


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
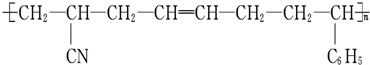 �����ɸ���֬�ĵ��������ͻ�ѧ��Ӧ����������ȷ���ǣ�������
�����ɸ���֬�ĵ��������ͻ�ѧ��Ӧ����������ȷ���ǣ�������| A��1�� �Ӿ۷�Ӧ |
| B��2�� ���۷�Ӧ |
| C��3�� �Ӿ۷�Ӧ |
| D��3�� ���۷�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������Ӽ��Ļ�����һ�������ӻ����� |
| B�����й��ۼ��Ļ�����һ���ǹ��ۻ����� |
| C�����ۼ�һ��ʹԭ�ӽ�ϳɹ��ۻ����� |
| D�����Ӽ��ɷ�Ϊ���Լ��ͷǼ��Լ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Fe��1mol Cl2ȼ�շ�Ӧʱ��ת�Ƶĵ�����Ϊ3NA |
| B��1mol NO2������H2O��Ӧ��ת�Ƶĵ�����ΪNA |
| C�����³�ѹ�£�9.2g��NO2��N2O4��������к��еĵ�ԭ����Ϊ0.2 NA |
| D�����¡��������ã�0.4 mol SO2������������Ӧ���ɵ�SO3������Ϊ0.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1molNa2O2��CO2��Ӧ������ת�Ƶĵ�����Ϊ4NA |
| B����״���£�11.2L H2O�к��еĵ�����Ϊ5NA |
| C��1mol/L Al2��SO4��3��Һ�к�Al3+��Ϊ2NA |
| D�����³�ѹ�£�14g N2������ԭ����ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
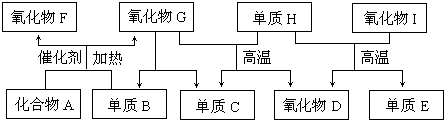
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
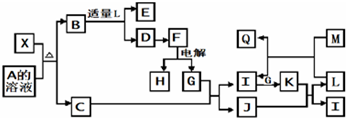
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��15.6g Na2O2�����к��е���������Ϊ0.6NA |
| B����״���£�22.4L CCl4�к��е�Cԭ����ĿΪNA |
| C��1mol Na������O2��Ӧ������Na2O��Na2O2�Ļ�����ʧȥNA������ |
| D��������������������Һ�����������6.72 L H2����Ӧ������ԭ����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com