
| A. | 17g氨气中所含质子数为10NA | |
| B. | 2.4g金属镁变成镁离子时失去电子数为0.1NA | |
| C. | 在标准状况下,22.4L氧气中所含的氧原子数为NA | |
| D. | 在25℃、压强为1.01×105Pa时,28g氮气所含的分子数为NA |
分析 A.氨气分子中含有10个质子,根据n=$\frac{m}{M}$计算出氨气的物质的量;
B.镁为+2价金属,根据n=$\frac{m}{M}$计算出镁的物质的量;
C.氧气分子为双原子分子,1mol氧气含有2mol氧原子;
D.根据n=$\frac{m}{M}$计算出氮气的物质的量.
解答 解:A.17g氨气的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol质子,所含质子数为10NA,故A正确;
B.2.4g金属镁的物质的量为:$\frac{2.4g}{24g/mol}$=0.1mol,0.1molMg变成镁离子时失去0.2mol电子,失去电子数为0.2NA,故B错误;
C.标准状况下22.4L氧气的物质的量为1mol,1mol氧气分子中含有2mol氧原子,所含的氧原子数为NA,故C错误;
D.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气中所含的分子数为NA,故D正确;
故选AD.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备溴苯时,将苯与溴水混合,剧烈振荡 | |
| B. | 除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸 | |
| C. | 在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去 | |
| D. | 在苯中铜氢气制备环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )| A. | 最简单氢化物的稳定性:R>Q>X;R>T>X | |
| B. | 五种元素中Z的活动性最弱,T的氧化物对应水化合物酸性最强 | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2的总能量一定大于NH3的总能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | N2和H2的总能量一定低于NH3的总能量 | |
| D. | NH3的能量一定高于N2的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
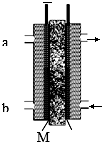 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答以下问题:
回答以下问题:| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com