
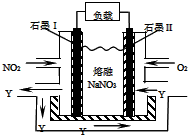
| A. | 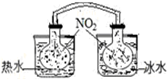 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 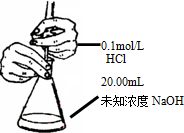 测定锥形瓶内的NaOH的浓度 | |
| C. | 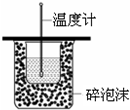 测定中和热 | |
| D. | 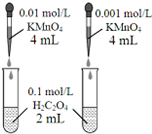 依据褪色快慢比较浓度对反应速率的影响 |
分析 A.N2O4是红棕色气体,放入热水中,平衡逆向移动;
B.缺少指示剂;
C.缺少搅拌器;
D.浓度不同其它条件相同时,根据溶液褪色快慢确定浓度对化学反应速率的影响.
解答 解:A.反应2NO2(g)?N2O4(g)为放热反应,放入热水中,平衡逆向移动,二氧化氮的浓度增大,颜色加深;放入冷水中,平衡正向移动,二氧化氮浓度减小,颜色变浅,故A正确;
B.缺少指示剂,无法判定滴定终点,故B错误;
C.该装置测定中和热,缺少搅拌器,故C错误;
D.两种溶液中高锰酸钾溶液浓度不同,其它条件相同,所以可以根据溶液褪色时间判断浓度对反应速率的影响,故D正确.
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学平衡、中和滴定、中和热测定、化学反应速率等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题
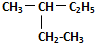 和
和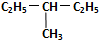 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
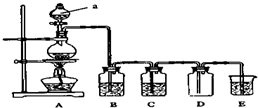 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com