
下列化学用语正确的是
A.1,2—二溴乙烷的结构简式:C2H4Br2 B.羟基的化学式:OH-
C.己烷的分子式:C6H12 D.乙烯分子的最简式:CH2
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.Be原子的结构示意图: B.乙酸的结构简式:
B.乙酸的结构简式:
C.中子数为16的硫原子: D.NH4Cl的电子式:
D.NH4Cl的电子式:
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加
剂,其结构如图。下列有关说法中正确的是
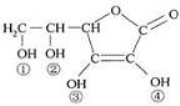
A.维生素C的分子式为C6H10O6
B.维生素C的酸性可能是③、④两个羟基引起的
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C由于含有酯基而难溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
下列各组物质中当总质量一定时,不论按何种比例混合,充分燃烧后,生成水的质量为一常量,且生成CO2质量也为一定值的是
A.甲醛、乙醇、乙二醇 B.苯、苯酚、苯乙烯
C.乙炔、苯、苯乙烯 D.甲烷、乙烷、乙烯
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
有机物  有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发
有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发
生显色反应的同分异构体有(不考虑立体异构)
A.6种 B.9种 C.15种 D.19种
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
方法一 | CO(g) +2H2(g) |
方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
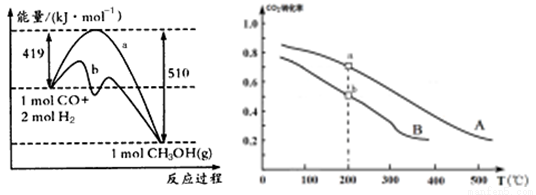
方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是
A.60克SiO2含有2NA个Si-O共价键
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(12分)【化学——化学与技术】
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
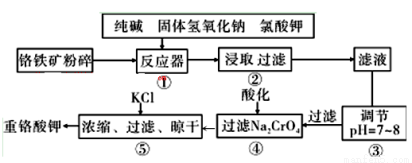
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于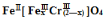 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:填空题
(6分)欲分离苯和苯酚,一般可向其混合物中加入稍过量的浓氢氧化钠溶液,反应的离子方程式为 。再将该混合物转移到分液漏斗中,振荡,静置后溶液将出现 现象,然后分液。从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是 ;向另一份溶液中加入浓溴水,发生反应的化学方程式是 。从分液漏斗上口倒出的上层液体是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com