
A.1 mol·L-1甲酸溶液的c(H+)约为1×10-2 mol·L-1
B.甲酸能与水以任意比例混合
C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电能力比硝酸溶液的弱
AD
解析:确定一种酸是弱电解质的方法有很多,主要判断依据有:①其电离是可逆的,电离过程存在电离平衡,该酸与强碱反应生成的正盐的溶液呈中性还是碱性;
②在相同条件下,该酸溶液与相同元数的强酸溶液导电能力的强弱比较;
③酸溶液的浓度与溶液中的c(H+)、pH的对应关系;
④该酸与相同浓度、同元数的强酸与活泼金属反应置换出H2速率的快慢;
⑤该酸与相同pH、同元数的强酸与活泼金属反应置换出H2量的多少;
⑥同pH的强酸和弱酸,分别加该酸的钠盐,溶液的pH增大的是弱酸,pH几乎不变的是强酸;
⑦同pH的强酸和弱酸,分别稀释相同的倍数(如100倍、1 000倍等),看溶液的pH变化等等。本题A项表明HCOOH没有完全电离,D项说明甲酸溶液中自由移动的离子浓度比硝酸溶液中小,也表明HCOOH没有完全电离。故选A、D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

 代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为
代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为

 其合成原料2-呲啶甲酸的结构式为
其合成原料2-呲啶甲酸的结构式为

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
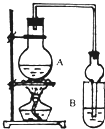 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
选做题
从以下两道题中任选一道做。
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为![]() ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
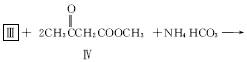
![]()
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。

(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。

Ⅵ
2.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
@@1. (1)C11H13NO4 (2)甲醛
(3)
(4)BC
(5)![]() 12
12
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实或实验现象,反映了硫酸的哪些性质?
(1)在工业上可用铁槽车或铝槽车运输浓硫酸_________________________________。
(2)浓硫酸与甲酸共热可制备一氧化碳_______________________________________。
(3)实验室用锌粒和稀H2SO4反应制备氢气___________________________________。
(4)浓硫酸露置在空气中质量增加____________________________________________。
(5)浓硫酸和食盐反应可生成NaHSO4和Na2SO4两种盐_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() 光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为
光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为![]() ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

![]()
![]() (1)化合物II的分子式为______________。
(1)化合物II的分子式为______________。
![]() (2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);
(2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);
![]()

![]() 化合物III的名称是________________。
化合物III的名称是________________。
![]() (3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为___________________。
(3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为___________________。

![]()
![]() (4)下列说法正确的是_____________(填字母)
(4)下列说法正确的是_____________(填字母)
![]() A. 化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
A. 化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
![]() B. 化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
B. 化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
![]() C. 化合物I、II、IV都可发生水解反应
C. 化合物I、II、IV都可发生水解反应
![]() D. 化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
D. 化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
![]() (5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见右图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。
(5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见右图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com