
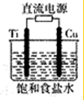
 ͭ�������������õĽ���֮һ��ͭ���γɶ�����Ҫ�Ļ����
ͭ�������������õĽ���֮һ��ͭ���γɶ�����Ҫ�Ļ�������� ��1���Ȼ�����Һ�͵�·���ϵ�ͭ��Ӧ�����Ȼ��������Ȼ�ͭ��
��2���ڼ��������£������������Ƶ�������ͭ��Ӧ����������ͭ��ɫ������������ͭ�����ֽ⣻
��3��CuI�ܶȻ�ԶԶС��CuCl����Ӧ����CuI������ͭ���ӱ���ԭ�������ӱ���������I2������KI����������CuI�ܶȻ�ԶԶС��CuCl��
��4����CuH������Ԫ�ؾ�Ϊ�ͼ�̬����������Ӧ���ɸ�̬���
�ڸ���������ԭ��Ӧ�е�ʧ�������������ƽ������ԭ��Ӧ�ķ���ʽ��
��5��ͭΪ����������������Ӧ����Cu2O���缫����ʽΪ2Cu-2e-+H2O=Cu2O+2H+��TiΪ�����������������ӵõ��������������ݴ˷�����
��� �⣺��1��FeCl3��Һ��ʴ��·������ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��
��2���ڼ��������£������������Ƶ�������ͭ��Ӧ����������ͭ��ɫ��������������ɫ������ʱ��������Һ�к��������ǣ�������ͭ�����ֽ����ɺ�ɫ��CuO��
�ʴ�Ϊ���죻Cu��OH��2�ֽ����ɺ�ɫ��CuO��
��3��CuI�ܶȻ�ԶԶС��CuCl����Ӧ����CuI������ͭ���ӱ���ԭ�������ӱ���������I2��CuCl2��Һ��KI��Һ��Ӧ�����ӷ���ʽΪ��2Cu2++4I-=2CuI��+I2��
����KI����������CuI�ܶȻ�ԶԶС��CuCl���������ɵ�CuCl��ת��ΪCuI��
�ʴ�Ϊ��2Cu2++4I-=2CuI��+I2������KI����������CuI�ܶȻ�ԶԶС��CuCl��
��4����CuH��������ȼ�������Ȼ�����Ȼ�ͭ������ʽΪ2CuH+3Cl2=2CuCl2+2HCl��
�ʴ�Ϊ��2CuH+3Cl2=2CuCl2+2HCl��
�ڷ�Ӧ��PԪ�صĻ��ϼ���+1�����ߵ�+5�ۣ�CuԪ�صĻ��ϼ���+2�۽��͵�+1�ۣ�HԪ�صĻ��ϼ���+1�۽��͵�-1�ۣ�����1��CuH�õ�3�����ӣ�����1��H3PO4ʧȥ4�����ӣ����ݵ�ʧ������Ŀ��ȿ�֪��������֮��Ϊ4��3�����������غ㶨�ɿ�֪ȱ��ˮ����ѧ����ʽΪ��3H3PO2+4CuSO4+6H2O�T4CuH��+3H3PO4+4H2SO4��
�ʴ�Ϊ��3��4��6H2O��4��3��4H2SO4��
��5��ͭΪ������Cuʧ���ӷ���������Ӧ����Cu2O���缫����ʽΪ2Cu-2e-+H2O=Cu2O+2H+��TiΪ�����������������ӵõ����������������ܷ�ӦΪH2O+2Cu $\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2������Һ��������Ũ�Ȳ��䣬����pH���䣻
�ʴ�Ϊ��2Cu-2e-+H2O=Cu2O+2H+�����䣻H2O+2Cu $\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2����
���� ���⿼����ͭ�Ļ���������ʣ���Ŀ�Ѷ��еȣ���Ŀ�漰������ԭ��Ӧ�����ӷ���ʽ����д�����ԭ����Ӧ�õȣ������ڿ���ѧ���ķ��������ͶԻ���֪ʶ���ۺ�Ӧ��������


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �٢ڢ� | C�� | �ݢޢ� | D�� | �ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 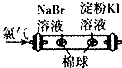 �Ƚ�Cl2��Br2��I2�����������ǿ�� | B�� |  ̽���ռ��ܽ�ʱ����ЧӦ | ||
| C�� | 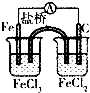 ����ѧ��ת��Ϊ���� | D�� |  ����һ�����ʵ���Ũ�ȵ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�������е����������������������е������� | |
| B�� | ���տ�����0.2 mol NH3 | |
| C�� | ��Ӧ��ƽ���ʹ�ô���������ʹƽ�������ƶ� | |
| D�� | ��n��N2����n��H2��=1��3ʱ��һ���ﻯѧƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ | |
| B�� | ��ѧƽ�����ۿ�ָ������ʹ������ԭ�϶����Ʒ | |
| C�� | ����Ӧ�ﵽ��ʱ���������������α仯����Ӧ��ϵ�ڸ����ʺ���ʼ�ղ��� | |
| D�� | ��ȷ���û�ѧ��Ӧ���ʺͻ�ѧƽ�����۶���������������ۺϾ���Ч�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
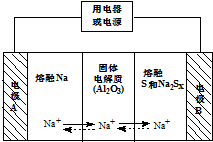 �����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ���ԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$2Na+xS ��3��x��5��
�����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ���ԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$2Na+xS ��3��x��5��| ���� | Na | S | Al2O3 |
| �۵�/�� | 97.8 | 115 | 2050 |
| �е�/�� | 892 | 444.6 | 2980 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com