
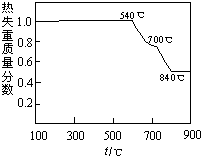
| ||
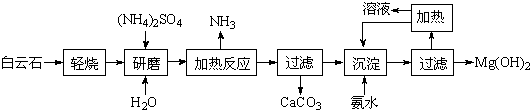
| Ksp(Mg(OH)2) |
| c2(OH-) |
| 5.61×10-12 |
| (10-4.5)2 |
| ||
| ||
| Ksp(Mg(OH)2) |
| c2(OH-) |
| 5.61×10-12 |
| (10-4.5)2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、E元素处于元素周期表中第3周期第ⅦA族 |
| B、元素A、B、C的原子半径:C>B>A |
| C、元素B、C、D的非金属性:C>B>D |
| D、一定条件下,A单质可以将D单质从其氧化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O |
| B、向水玻璃中加入盐酸有白色沉淀生成:2H++SiO32-=H2SiO3↓ |
| C、SO2使紫色石蕊溶液变红色:SO2+H2O?2H++SO42- |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1: | 火焰呈黄色,证明原溶液中存在Na+. |
| 步骤2: | |
| 步骤3:另取少量原溶液于试管中, | 品红溶液褪色,证明原溶液中存在SO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
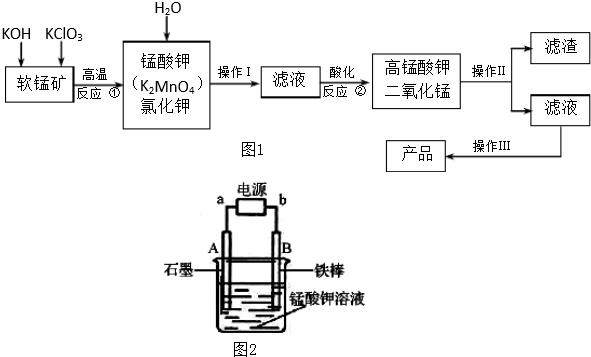
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com