
| A. | 0.01 mol•L-1 | B. | 0.017 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.50 mol•L-1 |
分析 设出氢氧化钠和盐酸溶液的物质的量浓度,混合液的pH=1,说明酸碱混合后,酸过量,剩余的c(H+)=0.1mol/L,据此列式计算.
解答 解:取浓度相同的NaOH和HCl溶液,以2:3体积比相混合,所得溶液的pH等于1,
反应后溶液中氢离子浓度为:(H+)=0.1mol/L,
设氢氧化钠和盐酸溶液的浓度都为c,氢氧化钠和盐酸溶液的体积分别为2V、3V,
则:$\frac{3Vc-2Vc}{2V+3V}$=0.1,
解得:c=0.50mol/L,
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的能够及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
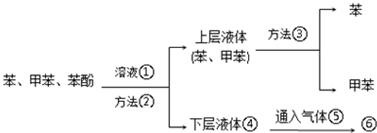
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
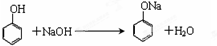
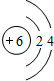 .
.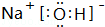 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量少 | |
| C. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| D. | 由热化学方程式 3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
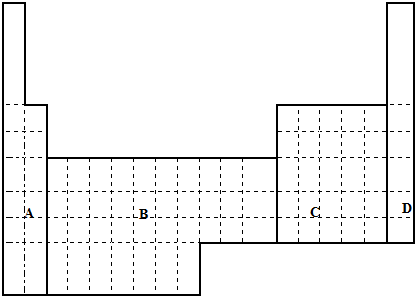
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
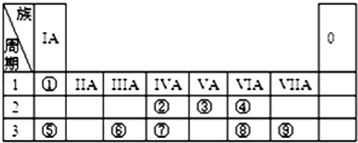
 ,Y中含有的化学键类型是共价键.
,Y中含有的化学键类型是共价键.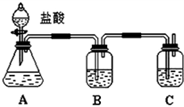
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化硫极易溶于水,且与水反应生成H2SO3 | |
| B. | SO3属于酸性氧化物 | |
| C. | 硫粉在过量的氧气中燃烧生成SO3 | |
| D. | SO2、SO3均具有漂白性,能使紫色石蕊溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com