
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为ⅠⅢⅣⅡVⅥ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:单选题
下列实验能达到目的的是
| A.用锌与稀硝酸制备H2 |
| B.用酸性KMnO4溶液鉴别1-戊烯和甲苯 |
| C.用丁达尔效应鉴别鸡蛋白溶液和食盐水 |
| D.用水来除去NO2中少量的NO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1) ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2) 用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8 000 mg/L~10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是_____性和_____性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是_____。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一根光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是__________。
(5)基于假设②,结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。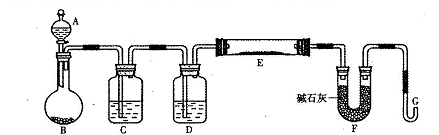
请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是__ __;
(3)试剂D是__ __,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是_ __(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g) △H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s) △H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学在气体体积测定仪中用镁和硫酸反应测定1 mol氢气体积。完成下列填空:
(1)A中发生反应的离子方程式为______________________。
(2)检查装置气密性的方法是塞上B瓶的玻璃塞,用橡皮塞塞紧A瓶加料口,当看到__________________现象时,可以确认装置气密性良好。
(3)已知液体量瓶的刻度范围是110~130 mL,实验时称取镁带的质量要控制在0.100~0.110 g之间,目的是_________。
(4)完成一次测定实验,需要2次用注射器抽气,其中需要记录的是第__________次抽出气体的体积。
(5)下列情况会导致实验结果偏高的是______(填编号)
a. 镁表面的氧化膜没有除尽 b. 储液瓶中的液体是水
c. 未冷却到室温就读数 d. 装置气密性不好
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
| 步骤3: | 若 则 ; 否则 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 。 | ,则证明生成 物中含Na2SO4。 |
| 步骤3:往Ⅱ试管中 。 | 若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com