
分析 (1)氯酸钾和二氧化锰加热分解反应生成氯化钾和氧气,二氧化锰起到催化剂的作用,结合反应前后质量变化计算生成氧气的体积;
(2)剩余固体为氯化钾和二氧化锰,利用化学方程式定量关系计算;
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,依据反应分析可知气体为氯气和氯化氢,通入过量的碘化钾溶液反应吸收氯气全部反应氧化碘离子为碘单质,生成的碘被0.02mol Na2S2O3吸收,依据化学方程式2Na2S2O3+I2→Na2S4O6+2NaI和Cl2+2I-=I2+2Cl-计算得到氯气物质的量,结合氯元素守恒计算得到氯化氢.
解答 解:把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,氯酸钾全部分解,剩余固体为16.15g为二氧化锰和氯化钾的质量,
(1)反应前后质量变化计算生成氧气的物质的量,2KClO3$\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑,反应前后二氧化锰质量不变,减少的是氧气的质量=20.95g-16.15g=4.8g,物质的量=$\frac{4.8g}{32g/mol}$=0.15mol,标准状况下气体体积=22.4L/mol×0.15mol=3.36L,
答:生成的气体在标态下的体积为3.36L;
(2)剩余固体为氯化钾和二氧化锰,依据(1)计算得到的氧气物质的量计算生成KCl的物质的量=0.1mol,则MnO2质量=16.15g-0.1mol×74.5g/mol=8.7g,所以二氧化锰物质的量=$\frac{8.7g}{87g/mol}$=0.1mol,
答:剩余固体各成分的物质的量分别为:KCl物质的量为0.1mol,MnO2物质的量为0.1mol;
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体为,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,依据反应分析可知气体为氯气和氯化氢,通入过量的碘化钾溶液反应吸收氯气全部反应氧化碘离子为碘单质,生成的碘被0.02mol Na2S2O3吸收,依据化学方程式:2Na2S2O3+I2→Na2S4O6+2NaI和Cl2+2I-=I2+2Cl-计算得到氯气物质的量为0.01mol,标准状况下的体积=0.01mol×22.4L/mol=0.224L,依据氯元素守恒得到HCl的物质的量=0.1mol-0.02mol=0.08mol,HCl标准状况下体积=0.08mol×22.4L/mol=1.792L,
答:生成的两种气体的体积(标态)氯气为0.224L,生成HCl气体体积为1.792L.
点评 本题考查了化学反应产物分析判断、化学方程式定量计算、气体摩尔体积和元素守恒的计算应用等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性 | |
| B. | Z元素的简单气态氢化物的沸点比Y的氢化物沸点高 | |
| C. | W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性 | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 10 | 20 | 30 | 40 |
| c(H2O2) mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
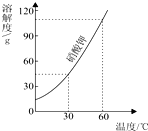
| A. | 硝酸钾的溶解度随温度的升高而增大 | |
| B. | 降低温度可以使接近饱和的硝酸钾溶液变饱和 | |
| C. | 60℃时120g硝酸钾与100g水充分混合可以形成饱和溶液 | |
| D. | 60℃时硝酸钾溶液中溶质质量分数一定大于30℃时硝酸钾溶液中溶质质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 用剩的药品应收集起来放回原试剂瓶中 | |
| C. | 振荡试管中液体时,手拿住试管,用手腕甩动 | |
| D. | 称量物质时先取小砝码,再依次取较大的砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+物质的量浓度为0.2mol/L | B. | 溶液中含1mol NaOH | ||
| C. | 溶液中含4gNaOH | D. | 物质的量浓度为0.2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com