
| A. | 金 | B. | 硫磺 | C. | 黄铜 | D. | 黄铁矿 |
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、次氯酸溶液和明矾都是混合物 | |
| B. | 不能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 | |
| D. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
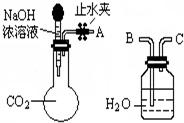 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
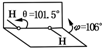 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2是极性分子 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在电离平衡:(NH4)2SO4?2NH4++SO42- | |
| B. | 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 | |
| C. | 加水稀释,溶液中所有离子的浓度均减小 | |
| D. | 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②③④⑤ | C. | ②⑤ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com