
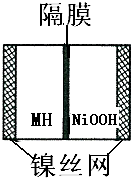
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、电池的电解液可为稀H2SO4溶液 |
| C、充电时负极反应为:MH+OH--e-═H2O+M |
| D、MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高 |


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、由强酸与强碱等物质的量反应得到的溶液 |
| C、使酚酞试液呈无色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
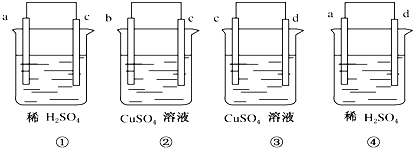
| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
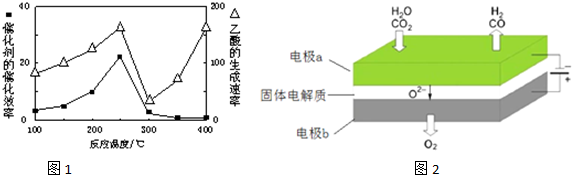
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
| ||
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol某粒子集体所含该粒子数与0.012kg12C中所含碳原子数相同 |
| B、1mol任何粒子的粒子数叫做阿伏加德罗常数,通常表示为6.02×1023mol-1 |
| C、O22-的摩尔质量为34g/mol |
| D、常温常压下28g N2所含分子数约为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com