
分析 燃烧热表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据“2mol乙醇(C2H5OH)在氧气中完全燃烧放出的热量为2733.6kJ”计算出1mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时放出的热量,然后写出乙醇燃烧热的热化学方程式.
解答 解:燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,
1mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为:2733.6kJ×$\frac{1}{2}$=11366.8kJ,
所以乙醇燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ•mo-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ•mol-1.
点评 本题考查了热化学方程式的书写,题目难度不大,明确燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{m{N}_{A}}{18n}$ | B. | $\frac{18m{N}_{A}}{n}$ | C. | 18mnNA | D. | $\frac{n{N}_{A}}{18n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |

| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
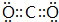 ;C2B2所含化学键为离子键、共价键.
;C2B2所含化学键为离子键、共价键.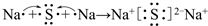 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(燃烧热) | |
| B. | 2S(s)+2O2(g)═2SO2(g);△H=-269.8kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 2:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油属于可再生矿物能源 | B. | 石油只含有碳、氢、氧三种元素 | ||
| C. | 将原油通过萃取、分液可获得汽油 | D. | 石油分馏所得的各馏分仍是混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com