
����Ŀ���ش������й�����
(1)KW����ѧ����ʽ��KW =__________���¶�����KW�ı仯�����______(ѡ�������������С������������)��
(2)Kͨ����ʾ��ѧƽ�ⳣ����KֵԽ���ʾ�÷�Ӧ���г̶�Խ________�����ڷ�Ӧ2NO2(g) ![]() N2O4(g),�仯ѧƽ�ⳣ��K����ѧ����ʽΪK=[N2O4]/[NO2]2��ʽ��[NO2]2��ʾ��������_______________��
N2O4(g),�仯ѧƽ�ⳣ��K����ѧ����ʽΪK=[N2O4]/[NO2]2��ʽ��[NO2]2��ʾ��������_______________��
(3)K��ͨ����ʾ����ĵ���ƽ�ⳣ����K��ֵԽ���ʾ�����������_______������ijһԪ��������������ˮϡ����ʱ����ҺԽϡ��K���ı仯�����________(ѡ�������������С������������)
(4)Ksp��ʾ��������ܶȻ��������ó���Խ���ʾ��������ˮ�е�__________��
(5)ʵ���ҿ���NaOH��Һ����NO2 ,��ӦΪ2NO2+2NaOH=NaNO3+NaNO2+H2O.��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0.1mol/L��CH3COONa��Һ,������Һ��c(NO3-)��c(NO2-) ��c(CH3COO-) �ɴ�С��˳��Ϊ_____________��(��֪HNO2�ĵ��볣��Ka=7.1��104 mol/L��CH3COOH�ĵ��볣��Ϊ��Ka=1.7��105 mol/L)����ʹ��ҺA����ҺB��pH��ȵķ�����_____________��
A.����ҺA�м�����ˮ B.����ҺA�м�����NaOH
C.����ҺB�м�����ˮ D.����ҺB�м�����NaOH.
���𰸡�c(H+)c(OH-) ��� ��ȫ NO2ƽ��Ũ�ȵ�ƽ�� Խǿ ���� ��� �ܽ���Խ�� c(NO3-)��c(NO2-)��c(CH3COO-) BC
��������
(1)ˮ�����ӻ�����KWָ������ϡ��Һ��c(OH-)��c(H+)�ij˻�����KW=c c(H+)c(OH-)��ˮ�ĵ�����������ȣ������¶ȴٽ�ˮ�ĵ��룬ʹc(OH-)��c(H+)������ˮ�����ӻ�����KW���
(2)��ѧƽ�ⳣ��KΪ������Ũ�ȵĻ�ѧ���������ݵij˻������Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻��ı�ֵ����KԽ��������Խ�࣬��Ӧ���е�Խ���ס���ȫ������ƽ�ⳣ������֪K=![]() ��ʽ��c2(NO2)��ʾ��������NO2ƽ��Ũ�ȵ�ƽ����
��ʽ��c2(NO2)��ʾ��������NO2ƽ��Ũ�ȵ�ƽ����
(3)����������ʵĵ��붼�����ȹ��̣�����KaֵԽ��Խ�����ڵ���ʵĵ��룬����Һ������Խǿ������ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬ƽ�ⳣ�����䣻ϡ��������Һ����ʹ�����̶�������ƽ�������ƶ���
(4)Ksp��ʾ��������ܶȻ�������һ������£��ó���Խ����˵����������ˮ�е��ܽ���Խ����
(5) 0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ӦΪ2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0.1mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol/L��CH3COONa��Һ����֪HNO2�ĵ��볣��Ka=7.1��10-4mol/L��CH3COOH�ĵ��볣��Ka=1.7��10-5mol/L��˵��CH3COOH����С��HNO2�����ԣ���Ӧ������ˮ��̶ȴ�������Ӻ������������ˮ�⣬����Һ��c(NO3-)��c(NO2-)��c(CH3COO-)�ɴ�С��˳��Ϊ��c(NO3-)��c(NO2-)��c(CH3COO-)��
ʹ��ҺA����ҺB��pHֵ��ȵķ�����������Һ��ɺ����ʷ�������ҺA��NaNO3���ʵ���Ũ��Ϊ0.1mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol/L��CH3COONa��Һ����ҺB���Դ���A��Һ��
A.����������֪����ҺB���Դ���A��Һ������ҺA�м�����ˮ��ϡ����Һ��Ũ�ȼ�С�����ܵ�����ҺpH��ͬ��A�����ϣ�
B.����ҺA�м�����NaOH��������ԣ����Ե�����ҺpH��ͬ��B���ϣ�
C.����ҺB�м�����ˮ��ϡ����Һ���Լ��������Ե�����ҺpH��C���ϣ�
D.��ҺB���Դ���A��Һ������ҺB�м�����NaOH����ҺpH�����ܵ�����ҺpH��ͬ��D��������
�ʺ���ѡ����BC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶������ԭ������С�ģ�BԪ��ԭ�ӵ��������������ڲ��������2����CԪ�ص�����������ˮ���������⻯���ܷ������Ϸ�Ӧ����һ���Σ�DԪ���ǵؿ��к�����ߵ�Ԫ�ء��ش��������⣺
(1)CԪ�ص�������____�������ڱ��е�λ����________��
(2)������BD2�Ľṹʽ��_________��������EA�ĵ���ʽ��___________��
(3)A��D��E����Ԫ���γɵĻ������к��еĻ�ѧ��������_________��
(4) D��EԪ�طֱ��γɵļ����Ӱ뾶��С��ϵ��_____(�����ӷ��ű�ʾ)��B��CԪ�طֱ��γɵļ���̬�⻯����ȶ��Դ�С��ϵ��___________(�û�ѧʽ��ʾ)��
(5)CԪ�صļ���̬�⻯������պ��Ũ����IJ�������������_________����ԭ����_________(�û�ѧ����ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ����������ӣ�H+��Mg2+��Al3+��NH4+��Cl����AlO2-���������Һ����μ���NaOH��Һʱ���������������ʵ���(n)�����NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ԭ��Һ��һ�����е���������H+��Mg2+��Al3+��NH4+
B. ��Ӧ����γɵ���Һ�е����ʺ�AlCl3
C. ԭ��Һ��Al3+��NH�����ʵ���֮��Ϊ1��3
D. ԭ��Һ�к��е���������Cl����AlO2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ǽ���������(S)�ǵ���ɫ�����ĩ��������ˮ��Ϊ����֤��Ԫ�صķǽ����Ա���Ԫ�صķǽ�����ǿ��ij��ѧʵ��С�����������ʵ�飬��ش��������⣺

��1��װ��A�ķ�Һ©����ʢװ���Լ���____________����ƿ�з����ķ�Ӧ�Ļ�ѧ����ʽ��______________________��
��2���������߿��ڵ�ʵ��װ��ͼ�������Լ�Ϊ____________����װ�õ�������__________________��
��3��װ��B��ʢ�ŵ��Լ���____________(�����)��ʵ������Ϊ____________________________���÷�Ӧ�����ӷ���ʽ��____________________________���÷�Ӧ�������ֻ�����Ӧ�����е�__________��Ӧ��
A��Na2S��Һ B��Na2SO3��Һ
C��Na2SO4��Һ
��4����֪��������ȴ������ȶ����ڸ���������Ա�����ǿ����S2����Cl���ױ���������HCl��H2S�ȶ�����ͭ�������Ӧ��������Ũ���ᷴӦ�������������ڼ��������·�Ӧ�������Ȼ������������ڼ��������·�Ӧ����������������ԭ������ԭ�ӵĵ��Ӳ�����ͬ���ȵ�ԭ�Ӱ뾶С����ԭ�ӡ���˵���ȵķǽ����Ա���ǿ����________(�����)��
A��ȫ�� B���ڢۢܢޢ�
C���٢ڢܢݢ� D���ڢۢܢݢޢ�
��5��װ��C��ʢ���ռ���Һ��Ŀ�������շ�Ӧ��ʣ������壬��ֹ��Ⱦ������д����װ������������Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Һ�е�����Ũ�ȹ�ϵ��ȷ����
A. NH4Cl��Һ�У�c(Cl)=c(NH4+)>c(OH)=c(H+)
B. Na2SO4��Һ�У�c(Na+)+c(H+)=c(SO42)+c(OH)
C. NaHCO3��Һ�У�c(Na+)>c(HCO3)>c(CO32)>c(OH)
D. Ũ�Ⱦ�Ϊ0.lmol/L��CH3COOH��CH3COONa��Һ�������Ϻ�pH=5��������Һ�У�c(CH3COO-)-c(CH3COOH)=2��(10-5-10-9) mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ��25����95��ʱ�������ƽ����������ͼ��ʾ��
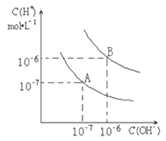
��1��25��ʱˮ�ĵ���ƽ������ӦΪ______��ѡ����A������B������
��2��25��ʱ����pH��9��NaOH��Һ��pH��4��������Һ��ϣ������û����Һ��pH��7����NaOH��Һ��������Һ�������Ϊ________��
��3��95��ʱ����100���pH��a��ijǿ����Һ��1���pH��b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ��a��b֮��Ӧ����Ĺ�ϵ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ǹɵ�ص����������Ѵ����ij���������̿���Ҫ�ɷ���MnO2��������Al2O3��SiO2������п����Ҫ�ɷ���ZnS��������FeS��CuS�����ʣ�Ϊԭ���Ʊ�MnO2��Zn���ɵ��ԭ�ϣ�������������£�
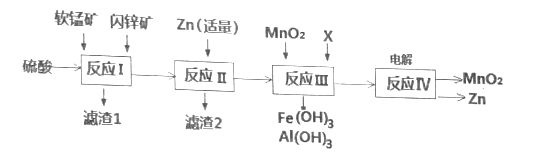
��֪��������Ӧ������н���Ԫ�ؾ���������ʽ���ڡ�
�ش��������⣺
��1������п�̸ɵ������п��Ϊ��������������Ϊ����������������ҺΪ����ʡ�����ܷ�ӦΪ2MnO2+Zn+2KOH=2MnOOH+K2ZnO2����д����ص�������Ӧʽ__________��
��2������1�г���SiO2���⣬����һ�ֵ���ɫ���ʣ�����������MnO2��CuS�����Ṳ��ʱ�����ģ���д���÷�Ӧ��ѧ����ʽ________________��
��3����Ӧ���м�����������п��Ŀ����Ϊ�˻���ij�ֽ�������д���÷�Ӧ�����ӷ���ʽ______��
��4����Ӧ����X������______��������ĸ���ţ�
a��MgO b��Zn(OH)2 c��Cu2(OH)2CO3 d��MnCO3
��5����֪��H2S�ĵ��볣��K1=1.0��107��K2=7.0��1015��0.1 mol/L NaHS��pH___7(�������������������
��6���ڷ�ˮ���������г���H2S��Mn2+ת��ΪMnS��ȥ������0.020 mol��L1 Mn2+��ˮ��ͨ��һ������H2S���壬������Һ��pH=a����HSŨ��Ϊ1.0��104 mol��L1ʱ��Mn2+��ʼ��������a=________��[��֪��Ksp(MnS)=1.4��1015]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʳ����������Ȼ����Ľṹ��ʽ��ͼ��ʾ������ڸ��л�����������ȷ�ĸ����ǣ� ��

�ٷ���ʽΪC12H20O2 ������ͬ���칹�����з����廯���� ����ʹ����KMnO4��Һ��ɫ ��1mol���л�����һ���������ܺ�3mol H2��Ӧ ���ܶȱ�ˮС ��1mol���л���ˮ��ʱ������1molNaOH������һ�����������ɸ߷��ӻ�����
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��VIAԪ�ص�����H2��Ӧ������̬H2X���Ȼ�ѧ����ʽ���£�
1/2O2(g) + H2(g) =H2O(g) ��H = -242 kJ��mol-1
S(g) + H2(g) =H2S(g) ��H = -20 kJ��mol-1
Se(g) + H2(g)![]() H2Se(g) ��H = +81 kJ��mol-1
H2Se(g) ��H = +81 kJ��mol-1
����˵����ȷ���ǣ� ��
A. �ȶ��ԣ�H2O > H2S > H2Se
B. ����������Se��H2��Ӧ����H2Se
C. O2(g) + 2H2S(g)=2H2O(g) + 2S(g) ��H = 444 kJ��mol-1
D. ���ź˵���������ӣ�VIA��Ԫ�ص�����H2�Ļ��Ϸ�ӦԽ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com