
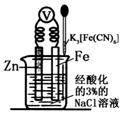
| A. | 该装置为电解池 | |
| B. | 本实验牺牲了金属Fe来保护金属Zn | |
| C. | 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀 | |
| D. | 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换 |
分析 锌的金属性强于铁,与铁构成原电池,在酸性条件下发生析氢腐蚀,锌易失电子作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:A.该装置没有外接电源,所以是原电池而不是电解池,故A错误;
B.锌活泼失电子作负极,铁作正极,所以牺牲了锌保护了铁,故B错误;
C.铁被保护,所以溶液中不会产生亚铁离子,加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀,故C正确;
D.远洋货轮船底镶嵌锌块,其中锌与铁构成原电池,锌活泼作负极失电子发生氧化反应,锌被腐蚀,为保护货轮需定期更换,故D错误;
故选C.
点评 本题考查了金属的电化学腐蚀与防护,明确原电池原理、亚铁离子的检验即可解答,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
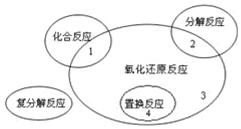
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 9 | C. | 12 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com