
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末。使用时加入水与其中的镁反应放出热量。下面是在室温下对本产品的两个探究实验。
实验1:向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果见下图。
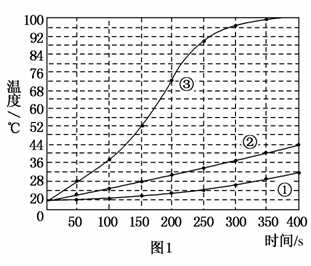
①1.0 mol镁条、0.10 mol铁粉、0.10 mol氯化钠粉末;
②将1.0 mol镁条剪成100份、0.10 mol铁粉、0.10 mol 氯化钠粉末;
③1.0 mol镁粉、0.10 mol 铁粉、0.10 mol氯化钠粉末;
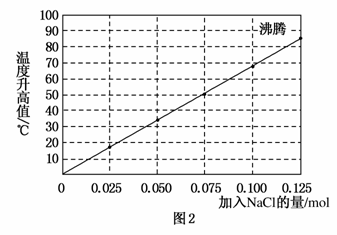
实验2:向加有100 mL水的多个相同的隔热容器中分别加入由0.10 mol镁粉、0.50 mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,结果见图2。
请回答下列问题:
(1)实验1证实了该反应的反应速率与________有关。
(2)实验2中当NaCl的用量大于0.125 mol时,实验就无须再做的原因是________(填选项字母)。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入0.060 mol的NaCl,则第15 min时混合物的温度最接近于________(填字母)。
A.34 ℃ B.42 ℃
C.50 ℃ D.62 ℃
(4)加入铁粉和NaCl能使反应速率加快的原因是_________________________________________________________。
科目:高中化学 来源: 题型:
实验室欲配制250 mL 1 mol·L-1氢氧化钠溶液。
(1)实验步骤如下:
①计算:需要NaOH固体质量为__________g。
②称量:用托盘天平称取NaOH固体,称量时要注意两个问题:一要装在烧杯里称,二要迅速。
③溶解:用量筒量取蒸馏水注入烧杯里,搅拌。
④冷却:将溶液冷却至室温。
⑤移液:将冷却溶液用__________引流到容量瓶中。
⑥洗涤:用适量蒸馏水洗涤烧杯和玻璃棒______________,并将洗涤液注入容量瓶里。
⑦振荡:手持容量瓶轻轻振荡,使溶液充分混合均匀。
⑧定容:继续加蒸馏水至距刻度线__________处,然后改用__________滴加蒸馏水正好至刻度线。
⑨摇匀:盖好玻璃塞,反复上下颠倒,使溶液均匀。
(2)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”“偏小”或“无影响”)。
①定容时俯视______________。
②定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种塑料分解产物为某种烃,对这种烃进行以下实验:
①取一定量的该烃,使其燃烧后的气体通过干燥管,干燥管增重7.2 g;再通过石灰水,石灰水增重17.6 g。
②经测定,该烃(气体)的密度是相同状况下氢气密度的14倍。
请回答:
(1)该烃的电子式为____________,该烃的名称是________。
(2)0.1 mol该烃能与________g溴起加成反应;加成产物需________mol溴蒸气完全取代。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒容的密闭容器中进行反应A(g)B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 mol·L-1需要20 s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为( )
A. 10 s B.大于10 s
C.小于10 s D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的性质说法正确的是( )
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙酸均能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
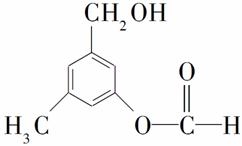
①可以使酸性高锰酸钾溶液褪色 ②可以和NaOH溶液反应 ③在一定条件下可以和乙酸发生反应 ④在一定条件下可以发生消去反应 ⑤在一定条件下可以和新制Cu(OH)2反应
A.①②③ B.①②③④
C.①②③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应2SO2 + O2  2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A、0.4mol B、0.6mol C、0.8mol D、1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com