
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
分析 2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3加升高为+4价,以此来解答.
解答 解:A.KClO3中Cl元素的化合价由+5价降低为+4价,得到电子被还原发生还原反应,则KClO3发生还原反应,故A正确;
B.H2C2O4中C元素的化合价由+3加升高为+4价,则H2C2O4在反应中被氧化,故B正确;
C.由氧化剂的氧化性大于氧化产物的氧化性可知,KClO3的氧化性强于CO2的氧化性,不能比较H2C2O4、ClO2的氧化性,故C错误;
D.每生成1 mol ClO2,转移的电子为1×(5-4)×6.02×1023=6.02×1023,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
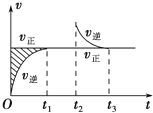 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下有一种是为气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1 mol•L-1 NaCl溶液 | B. | 100mL2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL1 mol•L-1 NH4Cl溶液 | D. | 150mL2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
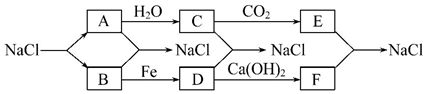
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
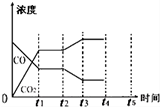
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com