
| A. | 酸性氧化物:CO2、SO2、H2O | B. | 碱性氧化物:Na2O、CaO、P2O5 | ||
| C. | 碱:NaOH、KOH、Ba(OH)2 | D. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4 |
分析 A、能和碱反应生成盐和水的氧化物称为酸性氧化物;
B、能和酸反应生成盐和水的氧化物称为碱性氧化物;
C、电离出来的阴离子全部是氢氧根离子的化合物为碱;
D、电离出来的阳离子是铵根离子、阴离子是酸根离子的化合物为铵盐.
解答 解:A、能和碱反应生成盐和水的氧化物称为酸性氧化物,水不是酸性氧化物,是不成盐氧化物,故A错误;
B、能和酸反应生成盐和水的氧化物称为碱性氧化物,P2O5不是碱性氧化物,是酸性氧化物故B错误;
C、电离出来的阴离子全部是氢氧根离子的化合物为碱,NaOH、KOH、Ba(OH)2均为碱,故C正确;
D、电离出来的阳离子是铵根离子、阴离子是酸根离子的化合物为铵盐,NH4Cl、NH4NO3、(NH4)2SO4均为铵盐,故D正确.
故选CD.
点评 本题考查了碱、盐的概念和氧化物的分类,应注意的是氧化物根据能和酸或碱反应分为酸性氧化物、碱性氧化物、两性氧化物和不成盐氧化物以及过氧化物等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
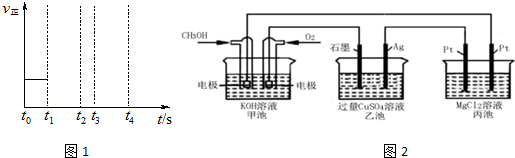
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
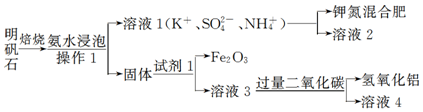
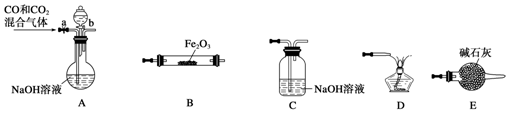
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应含有a | B. | 只含有b | C. | 比含有c | D. | 一定有a、b、c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的密度不变时.说明达到了平衡状态 | |
| B. | 加入少量的X,△H变大 | |
| C. | 加入一定量的惰性气体,平衡向左移动 | |
| D. | 加入少量的Y正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 300mL | C. | 490mL | D. | 720mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
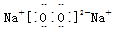 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com