
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
分析 A.发生的反应为Na2Si03+2C02+2H20=H2Si03(胶体)+2NaHC03;
B.向一定浓度的Na2Si03溶液里通入过量CO2气体,生成NaHC03;
C.胶体中分散质粒子直径为1~100nm,溶液中分散质粒子直径小于1nm;
D.硅酸不溶于水.
解答 解:A.发生的反应为Na2Si03+2C02+2H20=H2Si03(胶体)+2NaHC03,符合复分解反应的条件,故A正确;
B.向一定浓度的Na2Si03溶液里通入过量CO2气体,生成NaHC03,故B错误;
C.该反应得到硅酸胶体,胶体中分散质粒子直径为1~100nm,得到的NaHC03溶液中分散质粒子直径小于1nm,故C错误;
D.硅酸不溶于水,反应说明硅酸的酸性小于碳酸,故D错误;
故选A.
点评 本题考查了胶体和硅酸的性质,难度不大,明确发生的反应为Na2Si03+2C02+2H20=H2Si03(胶体)+2NaHC03是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
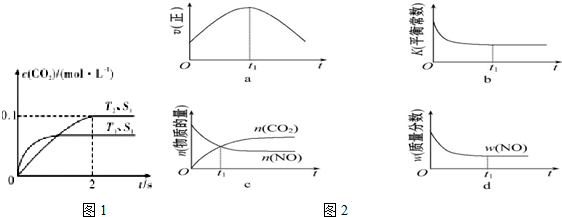
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 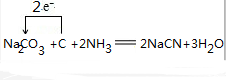 .
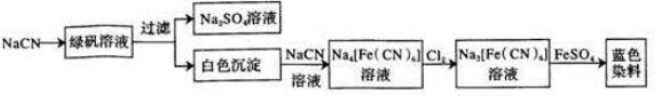
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
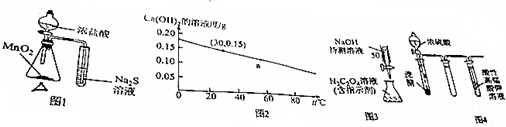
| A. | 图1的装置可用于比较MnO2、Cl2、S的氧化性 | |
| B. | 图2可知:30℃时Ca(OH)2溶液的浓度一定大于60℃时的温度 | |
| C. | 图3的装置可用于已知浓度的H2C2O4溶液测定未知浓度的NaOH溶液 | |
| D. | 图4的实验现象:酸性高锰酸钾溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反应类型是加聚反应.
,反应类型是加聚反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com