
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为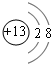 .
.分析 X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素,据此解答.
解答 解:X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素.
(1)碳元素的最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为 ,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为
,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为 ,
,
故答案为: ;
; ;
;
(2)单质碳和浓硝酸反应生成二氧化氮、二氧化碳与水,反应的化学方程式为:4 HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2+2H2O,
NH3分子间存在氢键,故氨气的沸点高于PH3的,
故答案为:4 HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2+2H2O;NH3分子间存在氢键;
(3)元素W为P,最外层电子数为5,位于周期表的第VA族;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱,
故答案为:VA;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱;
(4)R的一种氧化物能使品红溶液褪色,该氧化物为SO2,工业上用氨气水溶液作该氧化物的吸收剂,吸收剂与足量该氧化物反应的离子方程式:SO2+NH3•H2O═HSO3-+NH4+,
故答案为:SO2+NH3•H2O═HSO3-+NH4+;
(5)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,(3)中注意理解同主族、同周期元素性质的相似性与递变性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝的原子失电子能力比镁强 | B. | 氟的氢化物很稳定 | ||
| C. | 水比硫化氢稳定 | D. | 氢氧化钠比氢氧化镁的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
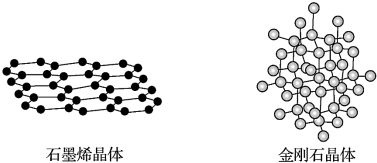
| A. | 在石墨烯晶体中,每个C原子连接3个六元环 | |
| B. | 在石墨烯晶体中,每个六元环占有3个C原子 | |
| C. | 在金刚石晶体中,C原子所连接的最小环为六元环,每个7C原子连接12个六元环 | |
| D. | 在金刚石晶体中,六元环中最多有4个C原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
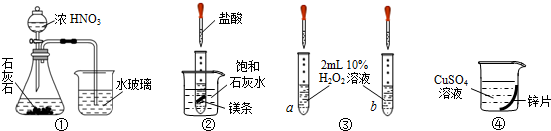
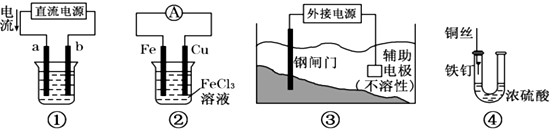
| A. | 实验①烧杯中出现白色胶状沉淀,证明非金属性:N>C>Si | |
| B. | 实验②烧杯中出现白色浑浊,说明镁与盐酸反应是放热反应 | |
| C. | 实验③a、b分别滴加2滴FeCl3溶液、CuSO4溶液,验证不同催化剂对反应速率的影响 | |
| D. | 实验④利用置换反应,证明金属单质还原性强弱,判断金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酚类化合物有毒,不能用于杀菌消毒 | |
| B. | 乙烯可催熟水果 | |
| C. | 石油的裂解可获得乙烯、丙烯等短链烯烃 | |
| D. | 甲醛的水溶液可用于防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; 的系统名称为:3,4,4一三甲基一l一戊炔
的系统名称为:3,4,4一三甲基一l一戊炔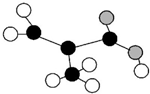 所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为
所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com