
| A. | C3H6 | B. | C2H6O | C. | C6H6 | D. | CH2Cl2 |
分析 同分异构体是分子式相同,但结构不同的化合物,根据是否存在同分异构体判断正误.
解答 解:A.C3H6存在同分异构体:丙烯、环丙烷,所以不能只表示一种物质,故A错误;
B.C2H6O可以存在同分异构体,可以是CH3CH2OH或CH3OCH3,所以C2H6O不能只表示一种物质,故B错误;
C.C6H6 不饱和度为4,可以是特殊结构的苯环,也可以是三键的链烃,所以C6H6 不能只表示一种物质,故C错误;
D.CH2Cl2只有一种结构不存在同分异构体,所以能只表示一种物质,故D正确;
故选D.
点评 本题考查同分异构体书写,难度不大,旨在考查学生对基础知识的理解与掌握,注意分子式代表物质的分析判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | N2和H2一定条件下反应制取NH3 | B. | 硝酸工厂用NH3氧化制取NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳酸氢铵和硫酸氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 硅是制造太阳能电池的常用材料 | |
| C. | NaOH溶液可以盛装在带橡皮塞的试剂瓶中 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、NO2 | B. | NaCl、KF | C. | NaOH、Ca(OH)2 | D. | MgO、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的物质变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3和SiO32-的中心原子的杂化方式相同,都是sp3杂化 | |
| B. | 分子构型为平面三角形 | |
| C. | NCl3比NBr3易挥发 | |
| D. | NC13是极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 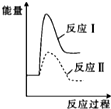 | C. | 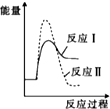 | D. | 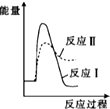 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com