
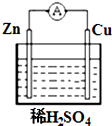
 如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:
如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:分析 铜锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,正极为较不活泼的铜,发生还原反应,据此分析.
解答 解:(1)铜锌原电池中,较为活泼的金属锌为原电池的负极,失去电子发生氧化反应,故答案为:负;氧化;
(2)较为活泼的金属锌为原电池的负极,失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)较为活泼的金属锌为原电池的负极,失去电子发生氧化反应,锌片上观察到的现象为锌逐渐溶解;故答案为:Zn片溶解;
(4)铜锌原电池中,正极为较不活泼的铜,发生还原反应,故答案为:正;还原;
(5)铜锌原电池中,正极为较不活泼的铜,氢离子在正极上得电子生成氢气,电极反应为,2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(6)氢离子在正极上得电子生成氢气,则铜片上观察到的现象是有气泡生成,故答案为:有气泡生成.
点评 本题考查原电池的工作原理,题目难度不大,注意正负极的判断和电极反应式的书写.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
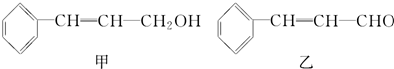
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
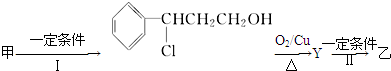
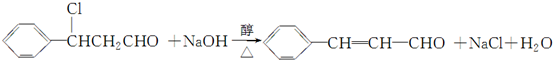 (注明反应条件).
(注明反应条件).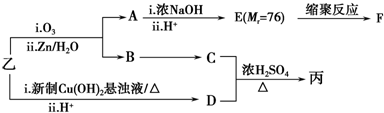
 .
.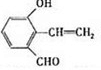 .
.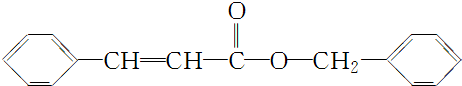 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加少量硫酸铜溶液 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com