
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
分析 A.漏掉镁离子与氢氧根离子的反应;
B.二价铁离子、溴离子都具有还原性,二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子;
C.得失电子不守恒;
D.氯化银为沉淀,应保留化学式.
解答 解:A.MgSO4溶液与Ba(OH)2溶液混合,离子方程式:Mg2++2OH-+Ba2++SO42-═BaSO4↓+Mg(OH)2↓,故A错误;
B.0.3molFeBr2与0.4molCl2在溶液中反应,则三价铁离子全部被氧化,溴离子只有部分被氧化,离子方程式:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2,故B正确;
C.Cu与稀HNO3反应,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C错误;
D.AgCl固体溶于足量氨水,离子方程式:AgCl+2NH3•H2O═[Ag(NH3)2]++2H2O+Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循得失电子守恒,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | H2O | B. | O2 | C. | CO2 | D. | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
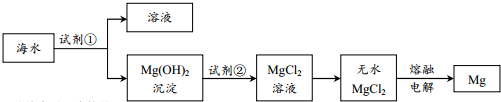
| A. | 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 | |
| B. | 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 | |
| C. | 加入试剂②反应的离子方程式为:OH-+H+=H2O | |
| D. | 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1NaHSO3溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO32-)>c(NH4+) | |
| B. | 0.1mol/L醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 已知Kw(HF)>Kw(CH3COOH),pH相等的NaF与CH3COOK两溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | 0.1mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合后的溶液中:3c(H+)+2c(CH3COOH)=c(CH3COO-)+3c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
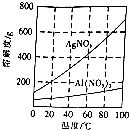 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | CH4(C2H4) | Br2水 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.20 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
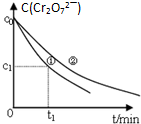 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com