

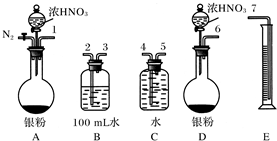
分析 (1)B容器中是二氧化氮和水反应生成硝酸和一氧化氮;100mL溶液中取出25.00mL溶液,用0.1mol•L-1的NaOH溶液滴定,用酚酞作指示剂,终点时,消耗氢氧化钠溶液的题为20.4ml-0.4ml=20ml;所以生成硝酸25.00mL溶液中含有0.02L×0.1mol/L=0.002mol,则B容器中生成硝酸的物质的量为0.008mol;由3NO2+H2O=2HNO3+NO可知金属反应生成二氧化氮物质的量为0.012mol;
(2)一氧化氮气体易被氧气氧化生成二氧化氮对验证产生干扰;选用图所示仪器组合一套可用来测定生成NO体积的装置,用水吸收生成的二氧化氮气体,可以用排水量气法测定一氧化氮气体的体积;依据量筒读取液体体积时需要和集气瓶液面向平,温度在常温下;
(3)若实验测得NO的体积为112.0mL(已折算到标准状况),结合二氧化氮反应生成的一氧化氮气体体积减小比较判断.
解答 解:(1)B容器中是二氧化氮和水反应生成硝酸和一氧化氮;100mL溶液中取出25.00mL溶液,用0.1mol•L-1的NaOH溶液滴定,用酚酞作指示剂,终点时,消耗氢氧化钠溶液的题为20.4ml-0.4ml=20ml;所以生成硝酸25.00mL溶液中含有0.02L×0.1mol/L=0.002mol;则B容器中生成硝酸的物质的量为0.008mol;由3NO2+H2O=2HNO3+NO可知金属与硝酸反应生成二氧化氮物质的量为0.012mol,
故答案为:0.008 mol;0.012 mol;
(2)①一氧化氮气体易被氧气氧化生成二氧化氮对验证产生干扰,AD相比A装置利用氮气可以把装置中 的空气排净;
故答案为:A;因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化;
②用A进行银和浓硝酸的反应,用水吸收生成的二氧化氮气体,导气管长进短出,可以用排水量气法测定一氧化氮气体的体积,排水集气瓶导气管应短进长出,连接顺序为:123547,
故答案为:123547;
③读数之前应保持内外压强相同,恢复到室温下读取量筒中 液体的体积,
故答案为:液体冷却到室温后,并使集气瓶和量筒内液面相平;
(3)实验测得NO的体积为112.0mL(已折算到标准状况),依据上述计算得到银和浓硝酸生成二氧化氮气体物质的量为0.012mol,依据3NO2+H2O=2HNO3+NO;计算得到一氧化氮气体物质的量为0.004mol,标准状况下体积为0.004×22.4L/mol=0.0896L=89.6ml<112.0mL可知银和硝酸反应生成一氧化氮气体,
故答案为:有.
点评 本题考查了物质性质的分析应用,实验设计的判断,物质反应的计算应用,主要考查及其化合物性质的分析应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和AgNO3溶液反应 | Cu+Ag+═Cu2++Ag | 正确 |
| B | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-═2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| D | 钠与硫酸铜溶液反应 | 2Na+Cu2+═Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
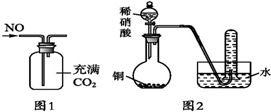
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
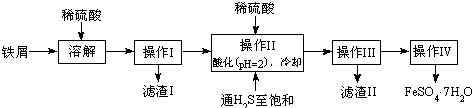
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
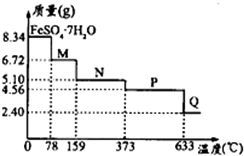
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若 W 是单质铁,则 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸钠,则 W 可能是盐酸 | |
| C. | 若 W 是氢氧化钠,则 X 与 Z 可反应生成 Y | |
| D. | 若 W 为氧气,则 Z 与水反应(或溶于水)一定生成一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
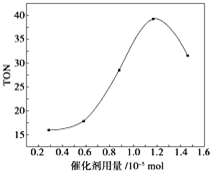
| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com