
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 苯和苯乙烯都不能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
分析 A.均含4个H,结合H原子守恒分析;
B.苯乙烯中含碳碳双键;
C.只含C、H元素的为烃,苯存在同分异构体;
D.丙烷和2-甲基丙烷均存在2种H.
解答 解:A.均含4个H,结合H原子守恒可知,甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol,故A正确;
B.苯乙烯中含碳碳双键,能使酸性高锰酸钾溶液褪色,但苯不能,故B错误;
C.甲烷、苯都属于烃,甲烷不存在同分异构体,但苯存在同分异构体,如CH≡C-CH2-CH2-C≡CH、CH3-C≡C-C≡C-CH3、CH2═CH-CH═CH-C≡CH等,故C错误;
D.丙烷和2-甲基丙烷均存在2种H,一氯代物均为两种,故D正确;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应、同分异构体等为解答的关键,侧重分析、应用能力的考查,注意选项C为解答的易错点,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
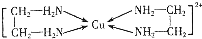 第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:
第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
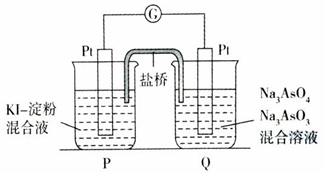
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
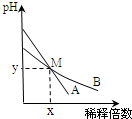 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| C. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH为7 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和 代表不同元素的原子.
代表不同元素的原子.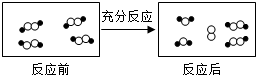
| A. | 一定属于吸热反应 | B. | 一定属于可逆反应 | ||
| C. | 一定属于氧化还原反应 | D. | 一定属于分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com