
| A、常温常压下,11.2 L氯气所含原子数目为NA |
| B、2 L 0.2 mol/L的K2SO4溶液中K+数目为0.8NA |
| C、1 mol Fe作还原剂可提供电子数为2NA |
| D、标准状况下,NA个CO2分子和NA个H2O分子的体积相同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AgCl不溶于水,不能转化为AgI | ||||
| B、在含浓度均为0.001mol?L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,先析出AgI | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可转化为AgI | ||||
D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
|
查看答案和解析>>
科目:高中化学 来源: 题型:
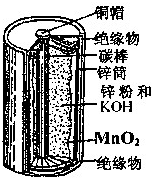
| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个氧分子的氧气的体积等于22.4L |
| B、Na2O2与H2O反应制O2,每生成1 mol O2转移4NA个电子 |
| C、1mol CH3OH在燃料电池负极发生反应时得到4NA个电子 |
| D、O.O1mol Mg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol/L的溶液 | X | Y | Z | W |
| PH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
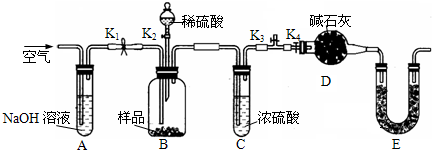
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温至30℃ |
| B、降温 |
| C、加入NaOH溶液 |
| D、加入稀HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com