
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |
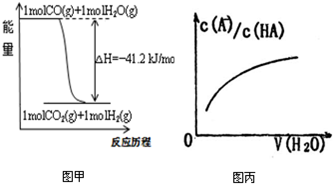
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
| c(A-) |
| c(HA) |
| 1 |
| 2 |
| c(A-) |
| c(HA) |


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:2011-2012学年福建省漳州市高三适应性检测化学试卷(解析版) 题型:选择题
下列关于各装置图的叙述不正确的是

A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com