
ЁОЬтФПЁПЮЊЬНОПФГВЛШмадЙЬЬхX(НіКЌЫФжждЊЫи)ЕФГЩЗжЃЌЩшМЦВЂЭъГЩСЫШчЯТЪЕбщЃК
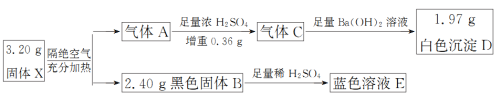
вбжЊЦјЬхAЪЧЛьКЯЮяЃЌЦјЬхCЪЧДПОЛЮяЧвЮоЩЋЮоЮЖЁЃЧыЛиД№ЃК
ЃЈ1ЃЉЦјЬхCЗжзгЕФНсЙЙЪНЮЊ______ЃЌКкЩЋЙЬЬхBЕФЛЏбЇЪНЮЊ______ЁЃ
ЃЈ2ЃЉИУСїГЬжаXИєОјПеЦјМгШШЗжНтЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
ЃЈ3ЃЉЯђРЖЩЋШмвКEжаМгШыKIШмвКЃЌгаАзЩЋГСЕэЩњГЩЃЌШмвКЕФбеЩЋдђгЩРЖЩЋБфЮЊЩюЛЦЩЋЃЌОЗжЮіАзЩЋГСЕэЪЧCuIЃЌаДГіИУЗДгІЕФРызгЗНГЬЪН___________ЁЃ
ЁОД№АИЁП![]() CuO 2Cu(OH)2ЁЄCuCO3
CuO 2Cu(OH)2ЁЄCuCO3![]() 3CuO+CO2Ёќ+2H2O 2Cu2++4I=2CuIЁ§+I2
3CuO+CO2Ёќ+2H2O 2Cu2++4I=2CuIЁ§+I2
ЁОНтЮіЁП
3.20 g XИєОјПеЦјГфЗжМгШШЗжНтЕУЕНЦјЬхAКЭ2.40 gКкЩЋЙЬЬхBЃЌИљОнжЪСПЪиКуЖЈТЩПЩжЊЃЌЦјЬхAЕФжЪСПЮЊ0.80 gЃЌОзуСПХЈСђЫсДІРэКѓЃЌХЈСђЫсдіжи0.36 gЃЌЪЃЯТЕФЦјЬхCгызуСПЧтбѕЛЏБЕШмвКЗДгІЩњГЩАзЩЋГСЕэDЃЌгЩгкЦјЬхCЮоЩЋЮоЮЖЃЌПЩвдХаЖЯГіЦјЬхCЮЊCO2ЃЌ1.97 gАзЩЋГСЕэDЮЊBaCO3ЃЌn(CO2)=0.01 molЃЛКкЩЋЙЬЬхBШмгкзуСПЯЁСђЫсЕУЕНРЖЩЋШмвКЃЌдђКкЩЋЙЬЬхBЮЊбѕЛЏЭЃЌЧвn(CuO)=0.03 molЃЌвђXжаНіКЌЫФжждЊЫиЃЌИєОјПеЦјМгШШЕУЕНЕФЦјЬхAжага0.36 gБЛХЈСђЫсЮќЪеЃЌЙЪXжаЛЙКЌгаHдЊЫиЃЌn(H)=![]() ЁС2 molЃЌXжаn(Cu)ЁУn(C)ЁУn(H)ЁУn(O)=0.03 molЁУ0.01 molЁУ0.04 molЁУ0.07 mol=3ЁУ1ЁУ4ЁУ7ЃЌЙЪXЕФЛЏбЇЪНЮЊ2Cu(OH)2ЁЄCuCO3ЁЃ
ЁС2 molЃЌXжаn(Cu)ЁУn(C)ЁУn(H)ЁУn(O)=0.03 molЁУ0.01 molЁУ0.04 molЁУ0.07 mol=3ЁУ1ЁУ4ЁУ7ЃЌЙЪXЕФЛЏбЇЪНЮЊ2Cu(OH)2ЁЄCuCO3ЁЃ
БОЬтжївЊПМВщЮяжЪЭЦЖЯЃЌвтдкПМВщПМЩњЕФзлКЯЗжЮіФмСІЁЃ
ЃЈ1ЃЉИљОнвдЩЯЗжЮіПЩжЊЦјЬхCЗжзгЕФНсЙЙЪНЮЊ![]() ЃЛКкЩЋЙЬЬхBЕФЛЏбЇЪНЮЊCuOЁЃЃЈ2ЃЉИУСїГЬжа2Cu(OH)2ЁЄCuCO3ИєОјПеЦјМгШШЗжНтВњЩњCuOЁЂCO2ЁЂH2OЁЃЃЈ3ЃЉРЖЩЋШмвКEЮЊH2SO4ЁЂСђЫсЭЕФЛьКЯШмвКЃЌМгШыKIШмвККѓЩњГЩCuIЃЌЫЕУїЗЂЩњСЫбѕЛЏЛЙдЗДгІЃЌдйИљОнШмвКЕФбеЩЋгЩРЖЩЋБфЮЊЩюЛЦЩЋЃЌПЩЭЦжЊЛЙЩњГЩСЫI2ЃЌЫљвдИУЗДгІЮЊСђЫсЭгыЕтЛЏМиЗДгІЩњГЩСђЫсМиЁЂЕтЕЅжЪКЭЕтЛЏбЧЭЃЌРызгЗНГЬЪНЮЊ2Cu2++4I=2CuIЁ§+I2ЁЃ
ЃЛКкЩЋЙЬЬхBЕФЛЏбЇЪНЮЊCuOЁЃЃЈ2ЃЉИУСїГЬжа2Cu(OH)2ЁЄCuCO3ИєОјПеЦјМгШШЗжНтВњЩњCuOЁЂCO2ЁЂH2OЁЃЃЈ3ЃЉРЖЩЋШмвКEЮЊH2SO4ЁЂСђЫсЭЕФЛьКЯШмвКЃЌМгШыKIШмвККѓЩњГЩCuIЃЌЫЕУїЗЂЩњСЫбѕЛЏЛЙдЗДгІЃЌдйИљОнШмвКЕФбеЩЋгЩРЖЩЋБфЮЊЩюЛЦЩЋЃЌПЩЭЦжЊЛЙЩњГЩСЫI2ЃЌЫљвдИУЗДгІЮЊСђЫсЭгыЕтЛЏМиЗДгІЩњГЩСђЫсМиЁЂЕтЕЅжЪКЭЕтЛЏбЧЭЃЌРызгЗНГЬЪНЮЊ2Cu2++4I=2CuIЁ§+I2ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЗДгІЪНЃКmX(g)+nY(?)![]() pQ(s)+2mZ(g)ЃЌвбжЊЗДгІвбДяЦНКтЃЌДЫЪБc(X)=0.3mol/LЃЌЦфЫћЬѕМўВЛБфЃЌШєШнЦїЫѕаЁЕНдРДЕФ
pQ(s)+2mZ(g)ЃЌвбжЊЗДгІвбДяЦНКтЃЌДЫЪБc(X)=0.3mol/LЃЌЦфЫћЬѕМўВЛБфЃЌШєШнЦїЫѕаЁЕНдРДЕФ![]() ЃЌc(X)=0.5mol/LЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
ЃЌc(X)=0.5mol/LЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЗДгІЯђФцЗНЯђвЦЖЏB.YПЩФмЪЧЙЬЬхЛђвКЬх
C.ЯЕЪ§n>mD.ZЕФЬхЛ§ЗжЪ§МѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A. дкЭтМгЕчСїЕФвѕМЋБЃЛЄЗЈжаЃЌаыНЋБЛБЃЛЄЕФИжЬњЩшБИгыжБСїЕчдДЕФИКМЋЯрСЌ
B. ЗДгІH2S(g)ЃЋZnO(s)===H2O(g)ЃЋZnS(s)дквЛЖЈЬѕМўЯТПЩздЗЂНјааЃЌЧвІЄS<0ЃЌдђІЄH>0
C. ГЃЮТГЃбЙЃЌЧтбѕШМСЯЕчГиЙЄзїЯћКФ2.24 L O2ЪБЃЌзЊвЦЕчзгЕФЪ§ФПЮЊ0.4ЁС6.02ЁС1023
D. ГЃЮТЯТЃЌKsp[Cu(OH)2]ЃН2.6ЁС10Ѓ19ЃЌpHЃН10ЕФКЌCu2ЃЋЕФШмвКжаЃЌc(Cu2ЃЋ)Ён2.6ЁС10Ѓ11molЁЄLЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтКЯГЩ 1 , 2ЃЖўТШввЭщЕФЪЕбщзАжУШчЭМЫљЪОЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ
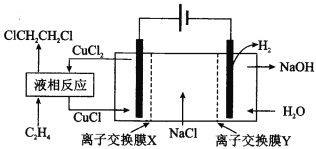
A. ИУзАжУЙЄзїЪБЃЌЛЏбЇФмзЊБфЮЊЕчФм
B. CuCl2ФмНЋC2H4ЛЙдЮЊ l , 2ЃЖўТШввЭщ
C. XЁЂYвРДЮЮЊбєРызгНЛЛЛФЄЁЂвѕРызгНЛЛЛФЄ
D. ИУзАжУзмЗДгІЮЊCH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋвЛЖЈжЪСПЕФЭЗлМгШыЕН 100 mL ФГХЈЖШЕФЯЁЯѕЫсжаЃЌГфЗжЗДгІКѓЃЌШнЦїжаЪЃга m1g ЭЗлЃЌДЫЪБЙВЪеМЏЕН NO ЦјЬх 448mLЃЈБъзМзДПіЃЉЃЎШЛКѓЯђЩЯЪіЛьКЯЮяжаМгШызуСПЯЁСђЫсжСВЛдйЗДгІЮЊжЙЃЌШнЦїШдЪЃгаЭЗл m2gЃЌдђЃЈm1Ѓm2ЃЉЮЊЃЈ ЃЉ
A.2.88B.5.76C.7.2D.11.52
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊNAЪЧАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ( )
A.48 gе§ЖЁЭщКЭ10 gвьЖЁЭщЕФЛьКЯЮяжаЙВМлМќЪ§ФПЮЊ13NA
B.78g ![]() жаКЌгаЫЋМќЪ§ЮЊ3NA
жаКЌгаЫЋМќЪ§ЮЊ3NA
C.17g![]() жаКЌгаЕФЕчзгЪ§ЮЊ9NA
жаКЌгаЕФЕчзгЪ§ЮЊ9NA
D.ГЃЮТГЃбЙЯТЃЌ1 LМзШЉЦјЬхЫљКЌЕФЗжзгЪ§аЁгкNA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїЯюВйзїЛђЯжЯѓФмДяЕНдЄЦкЪЕбщФПЕФЕФЪЧ
бЁЯю | ВйзїЛђЯжЯѓ | ЪЕбщФПЕФ |
A | НЋЬњЖЄЗХШыЪдЙмжаЃЌгУбЮЫсНўУЛ | бщжЄЬњЕФЮќбѕИЏЪД |
B | ЯђNaBrШмвКжаЕЮШыЩйСПТШЫЎКЭБНЃЌеёЕДЁЂОВжУЃЌШмвКЩЯВуГЪГШКьЩЋ | жЄУїBrЁЊЛЙдадЧПгкClЁЊ |
C | НЋТШЛЏбЧЬњЙЬЬхШмгкЪЪСПеєСѓЫЎжа | ХфжЦFeCl2ШмвК |
D | НЋЛьгаТШЛЏЧтдгжЪЕФТШЦјЭЈЙ§зАгаБЅКЭNaHCO3ШмвКЕФЯДЦјЦП | Г§ШЅТШЦјжаЕФHClЦјЬх |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮТЖШЮЊT1ЪБЃЌдкШ§ИіШнЛ§ОљЮЊ1LЕФКуШнУмБеШнЦїжаНіЗЂЩњЗДгІЃК2NO2(g)![]() 2NO(g)+O2(g)ЯрЙиЪ§ОнШчЯТБэЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
2NO(g)+O2(g)ЯрЙиЪ§ОнШчЯТБэЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
ШнЦї БрКХ | ЮяжЪЕФЦ№ЪМХЈЖШ (molЁЄL-1) | ЮяжЪЕФЦНКтХЈЖШ (molЁЄL-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ђё | 0.6 | 0 | 0 | 0.2 |
Ђђ | 0.3 | 0.5 | 0.2 | |
Ђѓ | 0 | 0.5 | 0.35 | |
A. ШнЦїЂёжаЗЂЩњЗДгІЕФЦНКтГЃЪ§ЮЊ0.8 B. ШнЦїЂђжаЗЂЩњЗДгІЕФЦ№ЪМНзЖЮгаvе§>vФц
C. ДяЕНЦНКтЪБЃЌШнЦїЂѓжа![]() >1 D. ДяЕНЦНКтЪБЃЌШнЦїЂёгыШнЦїЂѓжаЕФзмбЙЧПжЎБШЮЊ16ЁУ17
>1 D. ДяЕНЦНКтЪБЃЌШнЦїЂёгыШнЦїЂѓжаЕФзмбЙЧПжЎБШЮЊ16ЁУ17
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЫЎЕФЕчРыДяЕНЦНКтЃКH2OH++OH-ЁїHЃО0ЃЌЯТСаа№Ъіе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A. ЯђЦНКтЬхЯЕжаМгШыЫЎЃЌЦНКте§ЯђвЦЖЏЃЌc ЃЈH+ЃЉдіДѓ
B. НЋЫЎМгШШЃЌKwдіДѓЃЌpHВЛБф
C. ЯђЫЎжаМгШыЩйСПСђЫсЧтФЦЙЬЬхЃЌ  діДѓ
діДѓ
D. ЯђЫЎжаМгШыЩйСПNaOHЙЬЬхЃЌЦНКте§ЯђвЦЖЏЃЌcЃЈH+ЃЉНЕЕЭ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com