
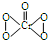
 下列说法正确的是( )
下列说法正确的是( )| A. | Cr2O72- 被氧化成CrO5 | |
| B. | 该反应为氧化还原反应 | |
| C. | 反应中H2O2被还原成H2O | |
| D. | 此反应用于检验Cr2O72-离子的存在 |
分析 由CrO5的结构式可知存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,Cr元素化合价为+6价,反应前后元素化合价没有发生变化,以此解答该题.
解答 解: 中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,Cr元素化合价为+6价,则反应Cr2O72-+4H2O2+2H+═2CrO5+5H2O中,反应前后元素化合价没有发生变化,不是氧化还原反应,由于生成2CrO5•(C2H5)2O,溶液变为深蓝色,则可用于检验Cr2O72-离子的存在,只有D正确.
中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,Cr元素化合价为+6价,则反应Cr2O72-+4H2O2+2H+═2CrO5+5H2O中,反应前后元素化合价没有发生变化,不是氧化还原反应,由于生成2CrO5•(C2H5)2O,溶液变为深蓝色,则可用于检验Cr2O72-离子的存在,只有D正确.
故选D.
点评 本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质所含元素化合价的判断,为解答该类题目的关键,难度中等.


科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ 1s22s22p63s23p6 | B. | O2-1s22s23p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2气体通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | SO2 | C. | CO2 | D. | C12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com