
 .
.
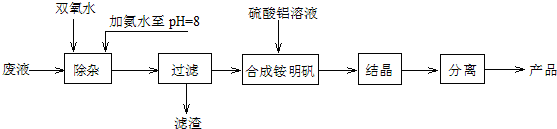
分析 由工艺流程可知,加入H2O2将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值至8,Fe3+转化为Fe(OH)3沉淀,过滤后滤渣为Fe(OH)3,滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)过氧化氢中H、O原子之间存在一对共用电子对,O原子之间也存在一对共用电子对;
(2)pH=8时铁离子能转化为Fe(OH)3;
(3)双氧水具有强氧化性,能氧化亚铁离子生成铁离子;
(4)NH4Al(SO4)2•12H2O不稳定,受热易失水;
(5)①NH4+、Al3+和OH-反应分别生成NH3、AlO2-、和H2O;
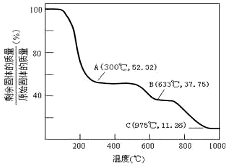
②如果晶体完全失去水,固体残留率=$\frac{237}{453}$×100%≈52%,则A点物质为NH4Al(SO4)2;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:$\frac{171}{453}$×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;
③硫酸铝分解生成C和一种氧化性气体,C物质应该具有还原性,C能溶于强酸、强碱,结合硫酸铝中元素知,C是Al,由反应方程式计算.
解答 解:由工艺流程可知,加入H2O2将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值至8,Fe3+转化为Fe(OH)3沉淀,过滤后滤渣为Fe(OH)3,滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)过氧化氢中H、O原子之间存在一对共用电子对,O原子之间也存在一对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)pH=8时铁离子能转化为Fe(OH)3,所以滤渣成分为Fe(OH)3,故答案为:Fe(OH)3;
(3)双氧水具有强氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)NH4Al(SO4)2•12H2O不稳定,受热易失水而不能实现目的,所以不能将溶液蒸干,
故答案为:防止晶体失去结晶水;
(5)①NH4+、Al3+和OH-反应分别生成NH3、AlO2-、和H2O,离子方程式为NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O,故答案为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;
②如果晶体完全失去水,固体残留率=$\frac{237}{453}$×100%≈52%,则A点物质为NH4Al(SO4)2;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:$\frac{171}{453}$×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解,根据图中数据知,固体残留物成分是Al2(SO4)3,故答案为:Al2(SO4)3;
③硫酸铝分解生成C和一种氧化性气体,C物质应该具有还原性,C能溶于强酸、强碱,结合硫酸铝中元素知,C是Al,Al和NaOH溶液、稀硫酸反应方程式分别为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、
2Al+3H2SO4=Al2(SO4)3+3H2↑,根据方程式知,相同物质的量的Al分别与NaOH、硫酸反应物质的量之比=2:3,故答案为:2:3.
点评 本题考查物质制备,为高频考点,涉及元素化合物之间转化、物质分离提纯、未知物成分确定等知识点,侧重考查学生分析判断及知识综合应用能力,难点是(5)题解答,注意铵明矾受热时反应先后顺序,题目难点中等.


科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
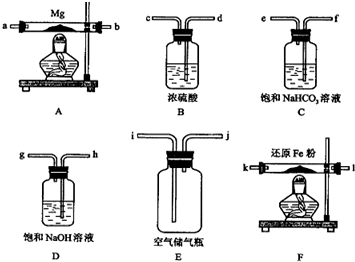
| 装置 | 目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
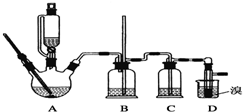
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com