
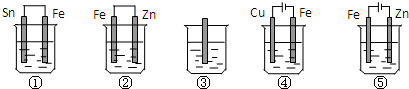
| A. | ①>②>③>④>⑤ | B. | ⑤>①>③>②>④ | C. | ⑤>①>②>③>④ | D. | ⑤>②>①>③>④ |
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 | |
| B. | 因为SO2有漂白性,所以它可使紫色石蕊溶液褪色 | |
| C. | 氯化钠溶液在电流作用下电离成Na+离子和Cl-离子 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸钠产生的CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

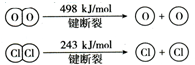
 ,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.
,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
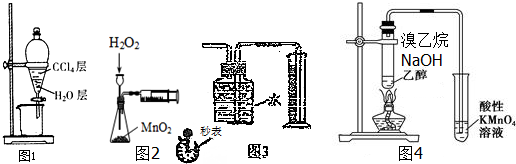
| A. | 实验室用图1所示装置萃取、分离溴水中的溴 | |
| B. | 实验室用图2所示装置可测定H2O2分解的化学反应速率 | |
| C. | 用图3所示装置收集并测定铜与稀硝酸反应生成的气体及体积 | |
| D. | 用图4所示装置检验有乙烯生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰水共存物、空气、氨水、二氧化硫 | B. | 胆矾、盐酸、硫酸钠、干冰 | ||
| C. | 生铁、福尔马林、浓硫酸、碳酸钙 | D. | 碱石灰、漂白粉、氧化钠、硫酸钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com