
| A. | 氯碱工业中,氢氧化钠在电解槽的阳极区产生 | |
| B. | 硫酸工业中,二氧化硫催化氧化使用催化剂,可增加二氧化硫的转化率 | |
| C. | 合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 | |
| D. | 接触法制硫酸中三氧化硫用水吸收制成浓硫酸 |
分析 A.电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;
B.催化剂影响反应速率,不影响化学平衡;
C.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可使平衡向正反应方向移动,则氨气的产率增大;
D.吸收三氧化硫应该用浓硫酸,否则易形成酸雾,影响吸收效果.
解答 解:A.电解池中和电源的正极相连的是电解池的阳极,阳极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,Cl2在电解槽的阳极区产生,故A错误;
B.二氧化硫催化氧化使用催化剂,目的是加快反应速率,催化剂不会影响化学平衡,故B错误;
C.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可使平衡向正反应方向移动,则氨气的产率增大,故C正确;
D.吸收塔中SO3如果用水吸收,会发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,故D错误;
故选C.
点评 本题考查常见化工反应原理及应用,题目难度中等,解答时须理解相关的化学反应发生的条件,试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
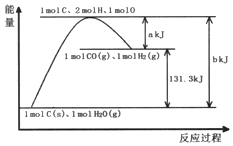
| A. | 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量 | |
| B. | 反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(a-b)KJ/mol | |
| C. | 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量 | |
| D. | 加入适当的催化剂,可以加快正、逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度溶液时,若加水超容最瓶刻度应用胶头滴管将多余溶液吸出 | |
| B. | 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大 | |
| C. | 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中 | |
| D. | 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
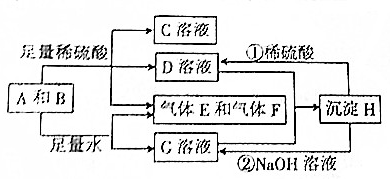
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:正己烷>3-甲基戊烷>2-甲基丁烷 | |
| B. | 含氢量:乙烯>乙苯>乙炔 | |
| C. | 密度:苯>H2O>CCl4 | |
| D. | 相同质量的物质含共用电子对总数:乙烷>乙烯>乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr比HCl的还原性强 | |
| B. | 卤素是非金属性较强的元素,故其单质只有氧化性 | |
| C. | 碘难溶于水,易溶于有机溶剂 | |
| D. | 碘单质能使湿润的碘化钾淀粉试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往0.3mol/L的NH3•H2O溶液中加入少量NaOH固体,NH3•H2O的电离平衡向逆反应方向移动,同时溶液中c(OH-)•c(NH4+)/c(NH3•H2O)将减小 | |
| B. | PH=9的NaOH溶液和NH3•H2O溶液中,由水电离出的c(H+)前者小于后者 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,PH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9)mol/L | |
| D. | 相同条件下,将足量的氢氧化铁固体加入到相同体积的下列溶液:①蒸馏水②0.1mol/L氢氧化钠③0.1mol/L氢氧化钡④0.1mol/L氯化铁,则铁离子浓度:④>①>②═③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集 NO2 气体 | |
| C. | 用 K3[Fe(CN)6]溶液检验 FeCl2 溶液中的 Fe2+ | |
| D. | 将 CO2 与 HCl 混合气体通过碱石灰可得到纯净的 CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com