
| A、无色溶液中:H+、Na+、I-、ClO- |
| B、pH=13的溶液:Na+、K+、SiO32-、CO32- |
| C、含有较多Ag+溶液:HCO3-、K+、Na+、Cl- |
| D、c(H+)=0.1 mol?L-1的溶液:Na+、NH4+、SO42-、S2O32- |


科目:高中化学 来源: 题型:
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
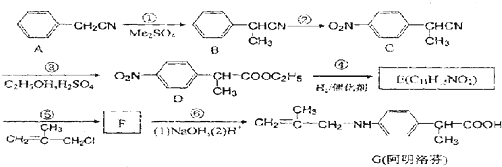
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变压强能改变气体反应的速率 |
| B、增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C、温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D、催化剂能加快化学反应速率主要原因是降低反应所需的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、iPhone5手机电池充电 |
| B、铁制品镀铜 |
| C、爆竹爆炸 |
| D、利用焰色反应检验Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
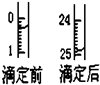 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.95 | 25.45 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 31.55 | 25.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、以食盐为原料制Na2CO3:2NaCl+2H2O
| |||||||
B、以铜和硫酸为原料制取硫酸铜:2Cu+O2
| |||||||
| C、从海水中提取MgCl2:MgCl2+2NaOH=Mg(OH)2↓+2NaCl Mg(OH)2+2HCl=MgCl2+H2O | |||||||
D、黄铁矿为原料制硫酸:4FeS+7O2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com