
用稀硫酸、氢氧化钠溶液和金属铝为原料制取Al(OH)3,甲、乙、丙三个学生制备的途径分别是
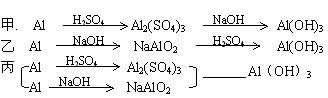
若要得到等量的Al(OH)3则
A.三者消耗原料相同 B.甲消耗的原料最少
C.乙消耗的原料最少 D.丙消耗的原料最少
科目:高中化学 来源: 题型:阅读理解
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜 | B、镁铝合金能完全溶于稀硝酸,同时生成无色气体,遇空气变成红棕色 | C、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气 | D、在高温下,可以用铝制的容器装运浓硫酸或浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为 .(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.
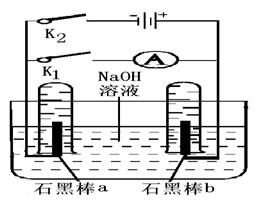
①断开K1,闭合K2接通直流电源,写出阳极 的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为 .(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.
①断开K1,闭合K2接通直流电源,写出阳极 的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三12月月考化学试卷 题型:实验题
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为 .(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.

①断开K1,闭合K2接通直流电源,写出阳极 的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com