
| |||||||||||||||||||||||||||||||
(1) |
答案:乙醇,浓H2SO4 解析:向容器中加液体的方法是先加密度小的,再加密度大的. |
(2) |
答案:①作催化剂②作吸水剂,有利于反应向生成酯的方向进行. 解析:该反应中浓硫酸的作用是作催化剂和吸水剂,有利于反应向生成酯的方向进行. |
(3) |
答案:防止暴沸中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层,提纯乙酸乙酯. 解析:对加热液体易暴沸的应加碎瓷片.制备乙酸乙酯的反应是: CH3COOH+CH3CH2OH |
(4) |
答案:小,水果香 解析:饱和碳酸钠溶液的作用是:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层,以提纯乙酸乙酯,所得乙酸乙酯是不溶于水、密度比水小且有水果香气味的液体. |
(5) |
答案:①防止倒吸②使乙酸乙酯充分冷凝 解析:上述装置中球形干燥管的作用是:防止倒吸,使乙酸乙酯充分冷凝. |
(6) |
答案:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物;③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐. 解析:甲、乙、丙三位同学的结果不同的原因是:甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物;丙同学加入的碱过量,使生成的酯已经水解为可溶性的醇和钠盐. |
(7) |
答案: 解析:由“分离乙酸乙酯、乙醇、乙酸混合物”的实验流程图知:试剂a是饱和碳酸钠溶液,b是稀硫酸;分离方法、、分别是分液、蒸馏、蒸馏;A、B、C、D、E的名称分别是:乙酸乙酯、乙醇和乙酸钠、乙酸钠、乙酸钠和乙酸、乙醇. |


科目:高中化学 来源: 题型:

| △Cu |
| △Cu |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
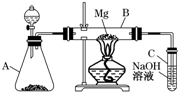 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
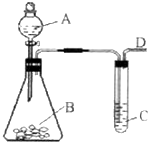 (2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.
(2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
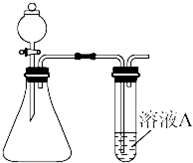 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
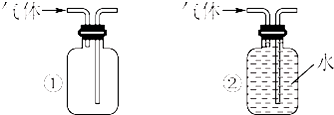
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com