
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,用强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.配合物中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-和Pt4+配位,而NH3分子不配位
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

(1)a电极材料为__________,其电极反应式为__________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液
C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是__________,在加入苯之前,对d溶液进行加热处理的目的是_______________________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
查看答案和解析>>
科目:高中化学 来源: 题型:
拟用如图所示装置制取下表中四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂)。
| 气体 | a | b | c | d |
| CO2 | 稀盐酸 | CaCO3 | 饱和NaHCO3溶液 | 浓硫酸 |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 氢氧化钠 |
| NO | 稀硝酸 | 铜屑 | H2O | P2O5 |

(1)上述方法中可以得到干燥、纯净的________气体。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)。
①气体________,理由:______________________________。
②气体________,理由:______________________________。
③气体________,理由:______________________________。
④气体________,理由:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素原子结合时所形成的化学键不一定是离子键
D.非金属原子之间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质中:①CO2 ②NaCl ③MgBr2 ④I2 ⑤NH4Cl ⑥Ca(OH)2 ⑦N2 ⑧H2S ⑨NH3
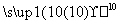 K2O2
K2O2
(1)只有非极性键的是_________________________________;
(2)只有极性键的是___________________________________;
(3)只有离子键的是___________________________________;
(4)有离子键,也有非极性键的是_______________________;
(5)既有离子键,又有极性键的是_______________________;
(6)属于离子化合物的是_______________________________;
(7)属于共价化合物的是_______________________________;
(8)含有配位键的物质是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.两个原子或多个原子之间的相互作用叫做共价键
B.阴、阳离子间通过静电引力而形成的化学键叫做离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.大多数的盐、碱和低价金属氧化物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是周期表中短周期的一部分。已知A、B
两元素原子的最外层电子数之和等于E元素原子的最外层电子数。下列有关说法正确
的是
A.元素B和E、B和D形成的化合物在固态时都属于分子晶体
B.工业上可用A、D形成的化合物制取A的单质;B的单质在信息业有广泛用途
C.与E同族的元素中,若简单阴离子的还原性越强,则该元素的最高价氧化物对应水化物的酸性也越
强
D.元素B的最简单氢化物分子的空间构型为正四面体,元素C的最简单氢化物的沸点比E的气态氢
化物的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硝酸的主要反应是4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度,K值________(填“增大”或“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是______
(填序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 浓度 时间 | c(NH3) (mol·L-1) | c(O2) (mol·L-1) | c(NO) (mol·L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
①起始时物料比c(O2)c(NH3)>1.25,其原因是________;
②反应在第2min到第4min时,O2的平均反应速率为__________mol·L-1·min-1;
③反应在第2min时改变了反应条件,改变的条件可能是__________(填序号);
a.使用催化剂 b.升高温度
c.充入He气体 d.增加O2的浓度
④反应在第8min时改变的反应条件可能是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com