
| A. | Na+、Al3+、OH- | B. | Ba2+、NO3-、SO42- | C. | K+、Na+、NO3- | D. | K+、NH4+、OH- |
分析 A.铝离子与氢氧根离子反应;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.三种离子之间不发生反应,能够共存;
D.铵根离子与氢氧根离子反应.
解答 解:A.Al3+、OH-之间发生反应,在溶液中不能大量共存,故A错误;
B.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.K+、Na+、NO3-之间不反应,能够大量共存,故C正确;
D.之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、天然气和石油是纯净物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键吸收的能量大于形成化学键所放出的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| a | b | |||
| c | d |
| A. | a的氢化物水溶液显酸性 | |
| B. | 在这4种元素中,b的氢化物热稳定性最好 | |
| C. | c的氧化物是碱性氧化物 | |
| D. | d的氧化物对应水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向水中加少量稀盐酸 | B. | 将纯水加热到100℃ | ||
| C. | 常温下,向水中加少量Na | D. | 常温下,向水中加少量Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,
, +2Na→
+2Na→ +H2↑
+H2↑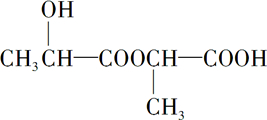 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数为3.75NA | |
| D. | 235g核素$\stackrel{239}{92}$U发生裂变反应:$\stackrel{239}{92}$ U+$\stackrel{1}{0}$n$\stackrel{裂变}{→}$$\stackrel{90}{38}$Sr+$\stackrel{136}{54}$U+10$\stackrel{1}{0}$n,净产生的中子($\stackrel{1}{0}$n)数为10 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com