
| (0.0040)2 |
| 0.0080×0.0080 |
| 0.0020mol/L |
| 0.010mol/L |
| (2x)2 |
| (0.02-x)2 |


科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ |
| 电常数 | 9×10-7 | 9×10-6 | 10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-够发生 |
| C、相同温度下,0.1 mol?L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol?L-1HX溶液的电离常数大于0.1 mol?L-1HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
 空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1
空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、H+ |
| B、AlO2-、Na+、Al3+、Cl- |
| C、Fe2+、SO42-、Cl-、Na+ |
| D、H+、AlO2-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用N2浓度的减少表示的平均反应速率为0.2mol?L-1?s-1 |
| B、2s时N2的转化率为40% |
| C、2s时混合气体中n(N2):n(H2):n(NH3)═3:9:4 |
| D、2s时NH3的浓度为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
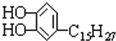 是我国特产漆的主要成分漆酚不应具有的化学性质( )
是我国特产漆的主要成分漆酚不应具有的化学性质( )| A、可以跟Na2CO3溶液反应放出CO2 |
| B、可以使酸性KMnO4溶液褪色 |
| C、可以跟FeCl3溶液发生显色反应 |
| D、可以跟溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CFClBrI分子中,各原子最外层均为8个电子 |
| B、含氧酸中,中心原子的化合价越高,其酸性越弱 |
| C、含有共价键的晶体一定具有高的熔、沸点及硬度 |
| D、金属晶体的空间利用率:简单立方堆积>六方最密堆积>体心立方堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| Y | CO2 | Fe2O3 | H2O | FeCl3 |
| W | MgO | Al2O3 | NaOH | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com