
【题目】现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)m+np(填“>”“=”“<”).
(2)若加压时,A的质量分数 . (填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率 .
(4)若降低温度,则平衡时B、C的浓度之比 ![]() 将 .
将 .
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色(填“变深”“变浅”或“不变”).
【答案】
(1)>
(2)减小
(3)增大
(4)增大
(5)不变
(6)变浅
【解析】解:(1)达到平衡后,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,故答案为:>;(2)加压,平衡向着方程式中气体的计量数之和减小的反应方向移动,即向着正反应方向移动,则A的质量分数减小,故答案为:减小;(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,故答案为:增大;(4)正反应吸热,则降低温度平衡向逆反应方向移动,B的物质的量增大,C的物质的量减小,所以二者的浓度比值将增大,故答案为:增大;(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变;(6)维持容器内压强不变,充入氖气时,容器的体积增大,所有反应物和生成物的浓度都会减小,所以颜色变浅,故答案为:变浅.(1)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和;(2)反应物的气体的计量数之和大于生成物气体的化学计量数之和,加压平衡正向移动;(3)加热A平衡正向移动,B的转化率增大;(4)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,降温平衡逆向移动;(5)催化剂不影响平衡移动;(6)维持容器内压强不变,充入氖气时,容器的体积增大,所有反应物和生成物的浓度都会减小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有一学生在实验室测某溶液pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
①这种错误操作(填“一定”/“一定不”/“不一定”)会导致实验结果有误差.
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 .
(2)用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考如图,从表中选出正确序号
序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |
|
A | 碱 | 酸 | 石芯 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1molL﹣1的醋酸溶液中不断滴人0.1molL﹣1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( ) 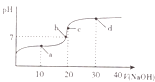
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO﹣)>c( H+)>c( OH ﹣)
B.b点时:c( Na+)=c( CH3COO﹣)>c(H+)=c( OH﹣)
C.c点时:c(H+)=c(CH3COOH)+c( OH﹣)
D.d点时:c(Na+)>c(CH3COO ﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
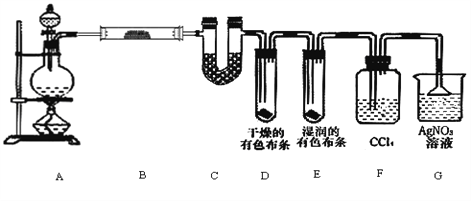
(1)若含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2 ,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是_______________________________________________。
(2)①装置B中盛放的试剂名称为__________,作用是________________________。装置C中盛放的试剂名称为_________________。
②装置D和E中出现的不同现象说明的问题是_________________________________。
③装置F的作用是_________________________。
④写出装置G中发生反应的离子方程式_____________________________________。
(3)为充分证明有氯化氢挥发出来,还应在装置F和G之间连接一个装有_________的广口瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55℃~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.
请填写下列空白:
①配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是: .
②步骤d中洗涤、分离粗硝基苯应使用的仪器是 .
③步骤d中粗产品用5% NaOH溶液洗涤的目的是 .
④制备硝基苯的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法不得当的是( )
A.戴上浸有氢氧化钠溶液的口罩撤离
B.向地势高的地方撤离
C.观察风向,逆风撤离
D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( ) 
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com