
 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的| 0.009mol×119g/mol |
| 1.23g |
| 0.09×119g/mol |
| 87.1% |


科目:高中化学 来源: 题型:
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物与氧气充分反应,转移的电子数为0.3NA |
| C、一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
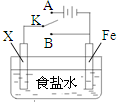
| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、Zn、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

A、在溶液中存在化学平衡I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为
| ||||
| B、第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降 | ||||
| C、3-18s内第2组实验中生成I3-的平均反应速率约为0.55mol/(L?s) | ||||
| D、Fe2+可作为O3氧化I-的催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com