
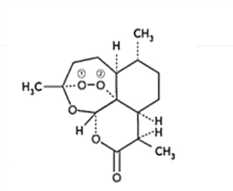
����Ŀ����֪�����л���X����Է�������С��180������������������ԼΪ49.4%����1molX��ϡ�����з���ˮ�ⷴӦ����2mol�״���1molA����X��û��֧�������л���X��A�����ܷ�������ͼת����ϵ��EΪ�߷��ӵĻ����BΪ��״�ṹ��
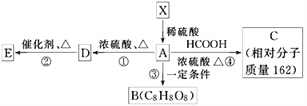
����������Ϣ��д���пհף�
��1��1��X�����У�����________����ԭ�ӣ�X�����ܷ����ķ�Ӧ��________(�����)��
�ټӳɷ�Ӧ ��������Ӧ ��������Ӧ ����ȥ��Ӧ
��2��д���ٵķ�Ӧ����_______��A�����еĹ�������(д����)________________��
��3��д���ܵĻ�ѧ����ʽ________________________________________��
��4���л��C8H8O8�����������к�������������Ŀ�еļ������֡�8��������Ϊ���������ӡ�����Aת�������ɵġ��������ӡ��ж��ֲ�ͬ�Ļ�״�ṹ��д�������������л���B��__________�ֽṹ�����еĺ�һ����Ԫ�����л���B�ṹ��ʽ___________________��
���𰸡� 5 �� ��ȥ��Ӧ �ǻ� �Ȼ� 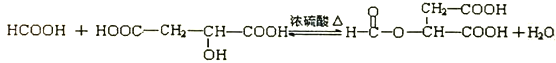 3��
3�� 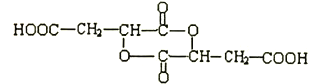
������������������Ϣ��֪һ����X�к�����������������1��A�����к�����-COOH���Ȼ������ٽ��A��C��ת����֪A������������һ���ǻ�������һ��X������������5����ԭ�ӣ�����X��������5����ԭ�ӣ�������Է�������Ϊ![]() ��162��180����X��������6����ԭ�ӣ�������Է�������Ϊ
��162��180����X��������6����ԭ�ӣ�������Է�������Ϊ![]() ��194��180����X��������5����ԭ�ӣ���������������1���ǻ�����A�������������Ȼ���1���ǻ�����A��Cת��Ϊ��A+HCOOH��C+H2O������A����Է�������Ϊ��162+18-46=134����������Է�������Ϊ��134-45��2-17=27����-C2H3������ΪX��������֧������A�Ľṹ��ʽΪ
��194��180����X��������5����ԭ�ӣ���������������1���ǻ�����A�������������Ȼ���1���ǻ�����A��Cת��Ϊ��A+HCOOH��C+H2O������A����Է�������Ϊ��162+18-46=134����������Է�������Ϊ��134-45��2-17=27����-C2H3������ΪX��������֧������A�Ľṹ��ʽΪ![]() �����ƿ�֪��XΪ
�����ƿ�֪��XΪ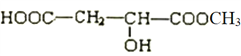 ��˳�ƿ�֪��CΪ
��˳�ƿ�֪��CΪ![]() ��A����������ȥ��Ӧ����D��DΪHOOC-CH=CH-COOH��D�����Ӿ۷�Ӧ����E���ݴ˽��
��A����������ȥ��Ӧ����D��DΪHOOC-CH=CH-COOH��D�����Ӿ۷�Ӧ����E���ݴ˽��
��⣺��1���������Ϸ�����֪XΪ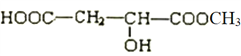 ����1��X�����к���5����ԭ�ӣ�X�����к����Ȼ����������ǻ������ܷ����ӳɷ�Ӧ���ܷ���������Ӧ��������Ӧ����ȥ��Ӧ����ѡ��
����1��X�����к���5����ԭ�ӣ�X�����к����Ȼ����������ǻ������ܷ����ӳɷ�Ӧ���ܷ���������Ӧ��������Ӧ����ȥ��Ӧ����ѡ��
��2������A�����е��ǻ�������ȥ��Ӧ����ٵķ�Ӧ��������ȥ��Ӧ��A�Ľṹ��ʽΪ![]() �����A�����еĹ��������ǻ����Ȼ���
�����A�����еĹ��������ǻ����Ȼ���
��3����Ӧ����A�е��ǻ�����ᷢ��������Ӧ����C����Ӧ�Ļ�ѧ����ʽΪ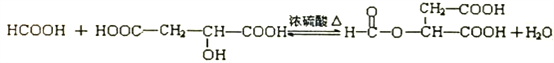 ��
��
��4����Aת�������ɵġ��������ӡ��ж��ֲ�ͬ�Ļ�״�ṹ��A����ͨ��������Ӧ�γɻ�״���������������ͬһ��̼ԭ���ϵ��ǻ����Ȼ�������Ҳ�����Dz�̼ͬԭ���ϵģ������ṹ��3�֣����ֱ��γ�6Ԫ����7Ԫ����8Ԫ�������к�һ����Ԫ�����л���B�ṹ��ʽΪ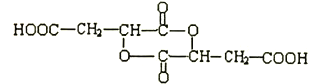 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǵӻƻ�������ȡ��һ����ɫ��״���壬˫���������������ص���Ҫ�������ű����Ч���������أ���ش��������⣺
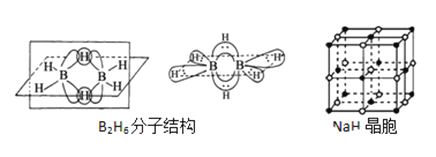
��1����������ص�����Ԫ�ص縺���ɴ�С������__________��������̬Oԭ�ӵļ۵����Ų�ͼ__________��
��2��һ�������ط����к���_______������̼ԭ�ӡ�
��3��˫�������صĺϳ�һ���������⻯��(NaBH4)��ԭ�����أ����⻯��ĺϳɷ����У� 2LiH+B2H6=2LiBH4�� 4NaH+BF3�TNaBH4+3NaF
��д��BH4���ĵȵ�����_________�����ӡ����Ӹ�дһ�֣���
��B2H6���ӽṹ��ͼ��2��Bԭ�Ӻ�һ��Hԭ�ӹ���2�������γ�3���Ķ����Ӽ����м��2����ԭ�ӱ���Ϊ������ԭ����������������2��Bԭ�ӣ���B2H6��������______�ֹ��ۼ���
��NaBH4����������һ��Bԭ�����γ�4�����ۼ���������ʯ(Na3AlF6)����������һ��Alԭ�ӿ����γ�6�����ۼ���ԭ����______________��
��NaH�ľ�����ͼ����NaH�����������ӵ���λ����_________���辧��������������Ϊ����������ǡ�����У������������ӵİ뾶��![]() =__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
=__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ����������ֶ�����Ԫ�ص�λ����ͼ��ʾ(�����ҡ���������λ��δ���)��
![]()
��֪����Ԫ�ص�ԭ������֮��Ϊ36���ҵ�ԭ��������ס���ԭ������֮����ȡ�
(1)��Ԫ�������ڱ��е�λ��Ϊ______________��
(2)���������γ�AB2�ͻ�����仯ѧʽΪ________��
(3)������Ȼ�����γɻ�������������Ԫ�أ������________(������)���䵥�����Ԫ�ص�����������Ӧˮ�����Ũ��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ��______________________��
(4)���ס��ҡ�����������Ԫ����������ʱ��������������Ԫ�صõ��Ļ�����������࣬����________(��Ԫ�ط���)��д����Щ���������������ַ������������Ļ�ѧʽ______________________
(��ԭ�Ӹ�����Ϊ1��2���ڷ����м۵�������Ϊż��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֲ�����ˮ�Ĺ���ǽ������������ͼ�е�ת����ϵ���ش��������⣺
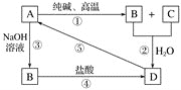
��1��д����ѧʽ��A��____________��D��____________��
��2��д����ط�Ӧ�Ļ�ѧ����ʽ����____________����____________��
��3��д����ط�Ӧ�����ӷ���ʽ����__________����__________����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�ij�����ܶ���1.25g��L-1��һ������ĸ�����ȫȼ������4.48LCO2��3.6gˮ�������ķ���ʽ_________________��
��2���л���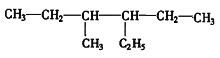 ����ȷ����Ϊ_______________________��
����ȷ����Ϊ_______________________��
��3��ij��lmol��2molHCl��ȫ�ӳɣ����ɵ��ȴ�������������6mol������Ӧ��������Ľṹ��ʽΪ_______________________��
��4����������������
�� ��
��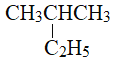 ������
������
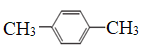
�������� ��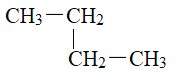 ��
��
���л�Ϊͬ���칹�����__________________(�����)���ڢۢܢ��������ʰ����ǵķе��ɵ͵��ߵ�˳����_______________(�����)���������Ģ٢ۢ��������ʣ���ȫȼ��ʱ����O2�����ʵ������ٵ����˳��Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� �� 25��ʱ��NH4Cl��Һ�����ԣ�ԭ����______ˮ������ģ�����NH4+������Cl-������
�� �����£�0.0100mol/L NaOH��Һ��pH=___________��
�� ��0.0100mol/L ����ζ�δ֪Ũ�ȵ�NaOH��Һ����̪��ָʾ�����ζ��յ�ʱ����Һ����ɫ��dz��ɫ��Ϊ_______��������ɫ��������ɫ�������Ұ��������ɫ���ֲ��䡣
�� ��֪��25�棺AgCl(s) ![]() Ag��(aq)��Cl��(aq) Ksp=1.8��10��10
Ag��(aq)��Cl��(aq) Ksp=1.8��10��10
Ag2S(s) ![]() 2Ag��(aq)��S2��(aq) Ksp=6.3��10��50
2Ag��(aq)��S2��(aq) Ksp=6.3��10��50
��Ũ�Ⱦ�Ϊ0.001 mol/L��NaCl��Na2S�Ļ����Һ�У���μ���AgNO3��Һ�����Ȳ����ij�����_________������AgCl������Ag2S������
��2����֪25��ϳɰ���Ӧ�У�1mol N2��ȫת��ΪNH3ʱ�ͷŵ�����Ϊ92.4 kJ���ֽ�1mol N2��3mol H2�������2L�ܱ������У���Ӧ���е�2sĩ���NH3Ϊ0.4mol��
�ش����У�
�� �÷�Ӧ���Ȼ�ѧ����ʽ��______________ ��
�� �÷�Ӧ�ﵽƽ��������¶�ƽ����_______ ����������������������Ӧ�����ƶ����������ƽ��________�������������������� ���������ƶ���
�� ǰ2s��v��H2����___________��
��3��ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������Ȼ��ȼ�ϵ���У��ڸ���������Ӧ�������� ________���ѧʽ��������õ���еĵ������Һ��KOH��Һ���缫B�缫�Ϸ����ĵ缫��Ӧʽ�ǣ�______________��
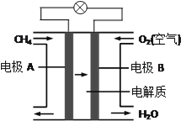 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ϸ���Ļ��������������ȷ����( )
A. DNA��������������������Ҫ�е���
B. RNA�����ֺ�������ɣ�������Ϊ�Ŵ�����
C. ��ɵ��ۡ���ԭ����ά�صĵ��嶼��������
D. �������������۵����ʱ�����ض����ܲ�δ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�ء�
�ش��������⣺
��1��L��Ԫ�ط���Ϊ________��M��Ԫ�����ڱ��е�λ��Ϊ___________������Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����_______________(��Ԫ�ط��ű�ʾ)��
��2��Z��X��Ԫ�ذ�ԭ����Ŀ��l��3��2��4���ɷ���A��B��A�ĵ���ʽΪ______��B�Ļ�ѧʽΪ____________,Z��X����Ԫ���γɵ�һ�ּȺ����Ӽ��ֺ����ۼ�����������Ϊ��____________��
��3����(se)������������Ԫ�أ���Lͬһ���壬Seԭ�ӱ�Lԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ_______��������������Ӧ��ˮ�����������ռ���Һ��Ӧ�Ļ�ѧ����ʽΪ____________��1mol���������������ʻ���ʱ��ת�Ƶĵ�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ѭ����ת������������������Ҫ�ļ�ֵ��
I��(1)д��ʵ�����Ʊ������Ļ�ѧ����ʽ________ ��
II��������Ҫ�Ļ���ԭ�ϡ�ij�����ð����������ε���������ͼ��ʾ��
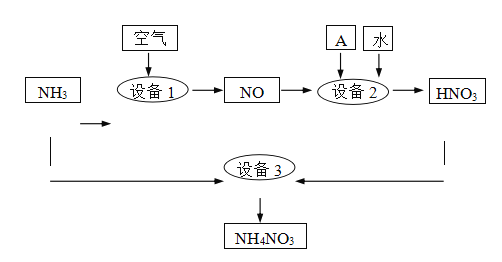
(2)�豸1��3�з�����Ӧ�Ļ�ѧ����ʽ�ֱ���______�� ________ ���豸2��ͨ�������A��________��
III��������ˮ��ȥ���ǵ�ǰ��ѧ�о����ȵ����⡣������ˮ�еĵ�Ԫ�ض���NH4+��NH3H2O����ʽ���ڡ�ij��������������ˮ���������£�
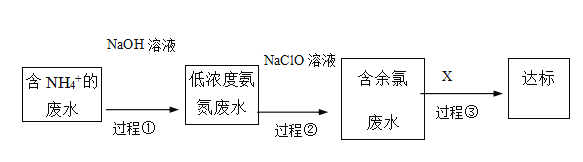
(3)���̢ٵ�Ŀ���ǽ�NH4+ת��ΪNH3����ͨ�������������������������д��NH4+ת��ΪNH3�����ӷ���ʽ________ ��
(4)���̢ڼ���NaClO��Һ�ɽ�����ת��Ϊ�����ʣ���Ӧ��Ԫ�ء���Ԫ�ص����ʻ�ѧʽ�ֱ�Ϊ___��_______��
(5)�����ȷ�ˮ����Ҫ�ɷ���NaClO�Լ�HClO��X��ѡ������������Һ�Դﵽȥ�����ȵ�Ŀ��(�����)_________��
a��KOH b��Na2SO3 c��KMnO4 D��NaCl
д������һ����Ӧ�����ӷ���ʽ__________ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com