
(1)跟金属反应作氧化剂:
__________________________________________________________________________
(2)跟非金属反应作氧化剂:
__________________________________________________________________________
(3)跟非金属反应作还原剂:
__________________________________________________________________________
科目:高中化学 来源:2012-2013学年河南省高三第三次考试化学试卷(解析版) 题型:填空题
(11分)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应I:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
反应II:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
(1)写出由CH3CH2OH +_____ 2CH3OH的热化学方程式为:__________________。
2CH3OH的热化学方程式为:__________________。
(2)在一定条件下,对于反应I:在体积恒定的密闭容器中,达到平衡的标志是__ (填字母)
a.CO2和CH3OH 浓度相等 b.H2O的百分含量保持不变
c.H2的平均反应速率为0 d.v正(CO2)=3v逆(H2)
e.混合气体的密度不再发生改变
f. 混合气体的平均相对分子质量不再发生改变
如果平衡常数K值变大,该反应 (填字母)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是 (填字母) ,
达到平衡后,想提高H2转化率的是_______________(填字母)
a、降低温度 b、补充H2 c、移去甲醇 d、加入催化剂
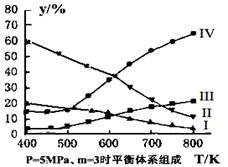
(3)在密闭容器中,对于反应II中,研究员以生产乙醇为研究对象,在5MPa、m= n(H2)/n(CO2)=3时,测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示,则表示CH3CH2OH体积分数曲线的是 ;表示CO2的体积分数曲线的是 。
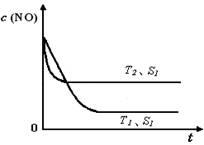
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。上图是反应:2NO(g)
+ 2CO(g)
 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线, 若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线, 若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅。
![]() ②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
③ SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
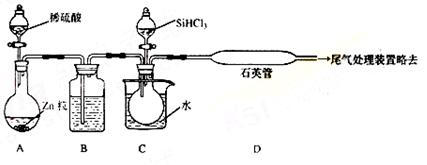
①装置B中的试剂是 ,装置C中的烧瓶需要加热,
其目的是: 。
②装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(17分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式为:
CH4(g)+2O?2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(l)=H2O(g) △H=+44kJ?mol-1
则356g“可燃冰”(分子式为CH4?9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:
O2+2CO2+4e-=2CO2-3,负极反应式 。
(3)已知一氧化碳与水蒸气的反应为:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | c1 |
6 | 0.096 | 0.266 | 0.104 | c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO(g)和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 。
③397℃时,该反应的化学平衡常数为12,请判断该反应的△H 0(填“>、=、<”)。
(4)燃料电池中产生的CO2气体可以用碱液吸水得到Na2CO3和NaHCO3。常温下向20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。根据图象回答下列问题:

①在同一溶液中,H2CO3、HCO-3、CO2-3(填:“能”或“不能”) 大量共存。②当pH=7时溶液中含碳元素的主要微粒为 ,此时溶液中c(HCO-3) c(Na+)(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢在催化剂作用下可快速产生氧气,它不仅是常用的消毒剂,还在航天和军事工业上有重要的用途。
(1)写出在过氧化氢溶液中加入MnO2粉末时,反应的化学方程式 。
(2)常用的消毒剂CH3COOOH(过氧乙酸),可以用冰醋酸和过氧化氢反应制取。制取时的化学反应方程式为 。该消毒剂中含有的少量过氧化氢,可以用它与高锰酸钾、次氯酸钠等强氧化剂的反应进行测定。请问,该消毒剂能否与漂粉精混合使用。
(3)过氧化氢和强还原剂液态肼(N2H4)可构成火箭推进剂。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 rnol液态肼与足量的过氧化氢反应,生成氮气和水蒸气,放出236.64kJ的热量。
①写出该反应的热化学方程式 。
②又知H2O(l)=H2O(g);![]() 44 kJ?mol
44 kJ?mol![]() ,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有―个很大的优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
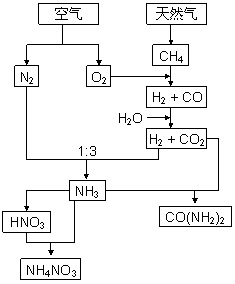
合成氨的发明是本世纪科学领域中最辉煌的成就之一。以下是与NH3相关的工业过程示意图。
已知:CH4(g) + 2O2(g) ==CO2(g)+2H2O(g)
△H = — 890kJ/mol
2CO(g) + O2(g) == 2CO2(g)
△H = — 566.0 kJ/mol
2H2(g) + O2(g) ==2H2O(g)
△H = — 571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g) 和H2(g)的热化学反应方程式:
_ 。
(2)生产中涉及H2和CO2的分离。你认为可取
的方法是(填代号) 。
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为: 。
(4)合成尿素的反应分两步进行:
①CO2(g)+ 2NH3(g)![]() H2NCOONH4(aq)△H = — 159.47kJ/mol
H2NCOONH4(aq)△H = — 159.47kJ/mol
(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
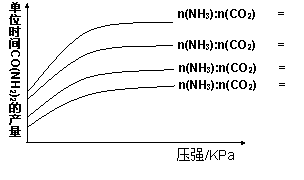 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产
量与压强和n(NH3):n(CO2)的关系如右图
所示。生产过程中n(NH3):n(CO2)的最佳
配比为 ,而实际生产往往使
n(NH3):n(CO2)≥3,这是因为
_ 。
在得到的尿素溶液中会含有少量的氨
基甲酸铵,除去这种杂质最简便的方法是 。
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3。若HNO3与NH3的反应是完全的,有标准状况下78.4LNH3经上述反应过程生成120g NH4NO3。则NH3转化为HNO3的转化率为 _ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com