
| ���������� �͵缫��Ӧʽ | ���������� �͵缫��Ӧʽ | ����ܷ�Ӧʽ | ��ҺŨ�ȱ仯 | ��ҺpH�ı仯 | |
| HCl | 2Cl--2e-=Cl2�� | 2H++2e-=H2�� | 2Cl-+2H+$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2�� | ��С | ���� |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;ͨ��\;}}{\;}$Br2+Cu | ��С | ���� |
| KCl | 2Cl--2e-=Cl2�� | 2H++2e-=H2�� | 2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH- | ��С | ���� |
| CuSO4 | 4OH--4e-=O2��+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+4H+ | ��С | ���� |
| NaOH | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
| H2SO4 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ��С |
| KNO3 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
| Na2SO4 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
���� ������������ǿ���������������Ϸŵ磬��ԭ��ǿ���������������Ϸŵ磬�������ĵ缫����ʽ��Ӽ��õ��ܵĵ�ⷽ��ʽ����ϵ�ⷽ��ʽ������ҺŨ�Ⱥ�pH�ı仯��
��� �⣺���HCl��Һ����������������ʧ����������������缫����ʽΪ��2Cl--2e-=Cl2�����������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2Cl-+2H+$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2������Һ���Ȼ����Ũ����С�������ӵ�Ũ����С��������Һ��pH����
���CuBr2��Һ����������������ʧ�������ɵ����壬��缫����ʽΪ��2Br--2e-=Br2��ͭ�����������ϵõ�������Cu����缫����ʽΪ��Cu2++2e-=Cu�������ܷ���Ϊ��2Br-+Cu2+$\frac{\underline{\;ͨ��\;}}{\;}$Br2+Cu����Һ���廯ͭ��Ũ����С����Һ��������Ũ�ȼ�С�������������ӵ�Ũ��������������Һ��pH����
���KCl��Һ����������������ʧ����������������缫����ʽΪ��2Cl--2e-=Cl2�����������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH-����Һ���Ȼ��ص�Ũ����С�����������ӵ�Ũ��������������Һ��pH����
���CuSO4��Һ��������������������ʧ����������������缫����ʽΪ��4OH--4e-=O2��+2H2O��ͭ�����������ϵõ�������Cu����缫����ʽΪ��Cu2++2e-=Cu�������ܷ���Ϊ��2Cu2++2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+4H+����Һ������ͭ��Ũ����С����Ӧ���������ӣ��������ӵ�Ũ��������������Һ��pH��С��
���NaOH��Һ��������������������ʧ����������������缫����ʽΪ��4OH--4e-=O2��+2H2O���������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2������Һ���������Ƶ����ʵ������䣬ˮ�������С�������������Ƶ�Ũ�����������������ӵ�Ũ��������������Һ��pH����
���H2SO4��Һ��������������������ʧ����������������缫����ʽΪ��4OH--4e-=O2��+2H2O���������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2������Һ����������ʵ������䣬ˮ�������С�����������Ũ�������������ӵ�Ũ��������������Һ��pH��С��
���KNO3��Һ��������������������ʧ����������������缫����ʽΪ��4OH--4e-=O2��+2H2O���������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2������Һ������ص����ʵ������䣬ˮ�������С����������ص�Ũ����������Һ�������ӵ�Ũ�Ȳ��䣬������Һ��pH���䣻
���Na2SO4��Һ��������������������ʧ����������������缫����ʽΪ��4OH--4e-=O2��+2H2O���������������ϵõ���������������缫����ʽΪ��2H++2e-=H2���������ܷ���Ϊ��2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2������Һ��Na2SO4�����ʵ������䣬ˮ�������С������Na2SO4��Ũ����������Һ�������ӵ�Ũ�Ȳ��䣬������Һ��pH���䣻
�ʴ�Ϊ��
| ���������� �͵缫��Ӧʽ | ���������� �͵缫��Ӧʽ | ����ܷ�Ӧʽ | ��ҺŨ�ȱ仯 | ��ҺpH�ı仯 | |
| HCl | 2Cl--2e-=Cl2�� | 2H++2e-=H2�� | 2Cl-+2H+$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2�� | ��С | ���� |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;ͨ��\;}}{\;}$Br2+Cu | ��С | ���� |
| KCl | 2Cl--2e-=Cl2�� | 2H++2e-=H2�� | 2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH- | ��С | ���� |
| CuSO4 | 4OH--4e-=O2��+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+4H+ | ��С | ���� |
| NaOH | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
| H2SO4 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ��С |
| KNO3 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
| Na2SO4 | 4OH--4e-=O2��+2H2O | 2H++2e-=H2�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$O2��+2H2�� | ���� | ���� |
���� ���⿼���˵���ԭ����Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�����������ӵķŵ�˳�ɽ��ע����ճ������ʵĵ�ⷽ��ʽ�������ڿ���ѧ���ķ��������ͶԻ���֪ʶ��Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1}{2}$ | B�� | $\frac{1}{3}$ | C�� | $\frac{1}{4}$ | D�� | $\frac{1}{8}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ�����淴Ӧ�������ı���ı� | |
| B�� | ʵ��������������Һ�Թ�����Ϊ��ʹ������ȫ�����������к� | |
| C�� | ʵ���в����û���ͭ�ʽ�������滷�β�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3 | B�� | 1��3 | C�� | 1��4 | D�� | 2��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������и�������Ӧ�Կ��Զ���ѧ�Ծ��������棩 ���ͣ������
��ˮ�����ظ����ƣ�Na2Cr2O7.2H2O����[��֪M��Na2Cr2O7.2H2O��=298g/mol]�׳ƺ췯�ƣ��ڹ�ҵ�����й㷺��;���ҹ�Ŀǰ��Ҫ���Ը�������Ҫ�ɷ�ΪFeO.Cr2O3��������A1203��MgO��Si02�����ʣ�Ϊ��Ҫԭ������������Ҫ����������ͼ��
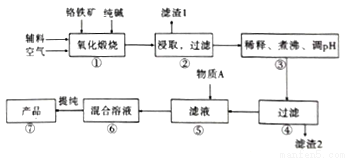
��֪��Ϣ��
��.���١����漰����Ҫ��Ӧ�ǣ�4FeO��Cr2O3��8Na2CO3��7O2=8Na2CrO4��2Fe2O3��8CO2
��.����������������������ʽ��ȫ����ʱ��Һ��PH���£�
������ | Al��OH��3 | Fe��OH��3 | Mg��OH��2 | Cr��OH��3 |
��ȫ����ʱ��ҺPH | 4.7 | 3.7 | 11.2 | 5.6 |
��1��������A12O3��SiO2�봿�Ӧת��Ϊ�������Σ�д��A12O3���Ӧ�Ļ�ѧ����ʽΪ��______________������1����Ҫ�ɷ�Ϊ__________________��
��2�������ۡ���ͨ������PH��ȥ���ʣ�����PH��___________��
��3�������ݡ�������Һ�м�������A���õ�Na2Cr2O3��Na2SO4�Ļ����Һ������AΪ__________������ԭ��______________________________���������ӷ���ʽ�����ּ���˵����
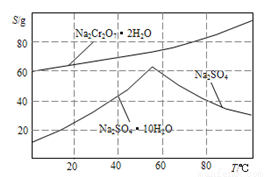
��4������ͼ��Na2Cr2O3.2H2O��Na2SO4���ܽ�����ߡ��ᴿ��ʵ���������Na2Cr2O3��Na2SO4�Ļ����Һ______________________���õ�Na2SO4����ͽϴ�����Na2Cr2O3��Һ��
��5����ʵ���Ҳⶨ���ò�Ʒ�к췯�ƵĴ��ȣ���ȡ��Ʒ3.2g�����250mol��Һ��ȡ��25.00mL����ƿ�У�����10mL2mol/LH2SO4�������⻯�أ����ڰ���5min��д�����ӷ���ʽ��________________��Ȼ���ˮ100mL������3mL����ָʾ������0.1000mol/LNa2S2O3����Һ�ζ�I2+2S2O32-=2I-+S4O62-���ﵽ�ζ��յ�ʱ������ȥNa2S2O3����Һ60mL�����ò�Ʒ�Ĵ�����_________���������С�����1λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������и�������Ӧ�Կ��Զ���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ������������ȷ����
A��0.5molCl2ͨ������ˮ�г�ַ�Ӧ��ת�Ƶĵ���������0.5NA
B��46gNO2��N2O4��������к���ԭ������Ϊ3NA
C����״���£�22.4LSO3�к��еķ�����ΪNA��
D��1L0.1mol/L��NaHSO3��Һ�У�HSO32-��SO32-��������֮��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ������ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ����������Һ��ֻ���ܺ��д�����Fe3+��Fe2+��H+��[Al(OH)4]����Al3+��CO32����NO3�����������еļ��֣������Һ����μ���һ����1mol/L NaOH��Һ�Ĺ����У���ʼû�г�����������г������������ж���ȷ����
A����Һ�п��ܺ���[Al(OH)4]�� B����Һ�п��ܺ���Fe3+����һ������Fe2+
C����Һ��һ������Fe2+��Fe3+ D����Һ�п��ܺ���NO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com