
根据电离平衡原理,设计实验证明NH3•H2O是弱碱。
可选用的试剂:酚酞、石蕊、稀氨水、醋酸铵晶体和蒸馏水。
| 实验操作 | 实验现象 |
| ① ② | |
| 结论: |
科目:高中化学 来源: 题型:
已知热化学方程式:SO2(g)+ 1/2O2(g)  SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
A. 196.64kJ B. 小于196.64kJ C. 小于98.32kJ D.大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
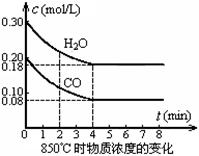 CO(g) + H2O(g)
CO(g) + H2O(g)  CO2(g) + H2(g) △H <0
CO2(g) + H2(g) △H <0
CO和H2O浓度变化如图,则0~4 min的平均反应速率v (CO)=____________mol / (L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | C1 | C1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | C2 | C2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | C3 | C3 | 0.084 | |
| H2 | 0 | 0.062 | C3 | C3 | 0.104 |
① 表中3 min ~ 4 min之间反应处于_________状态;
C1数值________0.08mol / L(填大于、小于或等于)。
② 反应在4 min ~ 5 min问,平衡向逆方向移动,可能的原因是________(单选),
表中5 min ~ 6 min之间数值发生变化,可能的原因是________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s) + CO2(g)  2 CO(g);△H>0。反应达到平衡后,下列条件能使反应向正方向进行的是
2 CO(g);△H>0。反应达到平衡后,下列条件能使反应向正方向进行的是
A.降低温度和减小压强 B.升高温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,水的电离达到平衡:H2O  H+ + OH- ;ΔH > 0 。下列叙述正确的是
H+ + OH- ;ΔH > 0 。下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq)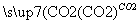 Al(OH)3
Al(OH)3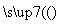 Al2O3(熔融)
Al2O3(熔融)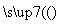 Al
Al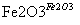 Fe
Fe
②S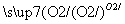 SO3
SO3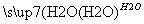 H2SO4
H2SO4
③Cu2(OH)2CO3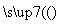 CuCl2(aq)
CuCl2(aq)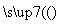 Cu
Cu
④Fe2O3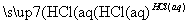 FeCl3
FeCl3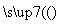 无水FeCl3
无水FeCl3
⑤饱和NaCl(aq)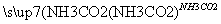 NaHCO3
NaHCO3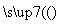 Na2CO3
Na2CO3
A.①③⑤ B.②③④
C.②④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W |
|
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关“化学与生活”的叙述不正确的是
A、 点燃爆竹后,硫燃烧生成SO3
B、 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C、 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
D、 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
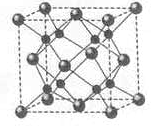
.[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 .。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com