
 ŅŃÖŖA”¢B”¢C”¢D¾łĪŖĒ°ĖÄÖÜĘŚŌŖĖŲĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŌŖĖŲAµÄ»łĢ¬Ō×Ó2p¹ģµĄÓŠ3øöĪ“³É¶Ōµē×Ó£¬ŌŖĖŲBµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×ÓŹżµÄ3±¶£¬ŌŖĖŲCµÄŅ»ÖÖ³£¼ūµ„ÖŹĪŖµ»ĘÉ«·ŪÄ©£¬DµÄÄŚ²ć¹ģµĄČ«²æÅÅĀśµē×Ó£¬ĒŅ×īĶā²ćµē×ÓŹżĪŖl£®
ŅŃÖŖA”¢B”¢C”¢D¾łĪŖĒ°ĖÄÖÜĘŚŌŖĖŲĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŌŖĖŲAµÄ»łĢ¬Ō×Ó2p¹ģµĄÓŠ3øöĪ“³É¶Ōµē×Ó£¬ŌŖĖŲBµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×ÓŹżµÄ3±¶£¬ŌŖĖŲCµÄŅ»ÖÖ³£¼ūµ„ÖŹĪŖµ»ĘÉ«·ŪÄ©£¬DµÄÄŚ²ć¹ģµĄČ«²æÅÅĀśµē×Ó£¬ĒŅ×īĶā²ćµē×ÓŹżĪŖl£®·ÖĪö A”¢B”¢C”¢D¾łĪŖĒ°ĖÄÖÜĘŚŌŖĖŲĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŌŖĖŲAµÄ»łĢ¬Ō×Ó2p¹ģµĄÓŠ3øöĪ“³É¶Ōµē×Ó£¬ŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p3£¬ŌņAĪŖNŌŖĖŲ£»ŌŖĖŲBµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×ÓŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņBĪŖOŌŖĖŲ£»ŌŖĖŲCµÄŅ»ÖÖ³£¼ūµ„ÖŹĪŖµ»ĘÉ«·ŪÄ©£¬ŌņCĪŖSŌŖĖŲ£»DµÄÄŚ²ć¹ģµĄČ«²æÅÅĀśµē×Ó£¬ĒŅ×īĶā²ćµē×ÓŹżĪŖl£¬Ō×ÓŠņŹż“óÓŚS£¬Ö»ÄÜ“¦ÓŚµŚĖÄÖÜĘŚ£¬ŗĖĶāµē×ÓŹż=2+8+18+1=29£¬ŌņDĪŖCuŌŖĖŲ£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗA”¢B”¢C”¢D¾łĪŖĒ°ĖÄÖÜĘŚŌŖĖŲĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŌŖĖŲAµÄ»łĢ¬Ō×Ó2p¹ģµĄÓŠ3øöĪ“³É¶Ōµē×Ó£¬ŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p3£¬ŌņAĪŖNŌŖĖŲ£»ŌŖĖŲBµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×ÓŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņBĪŖOŌŖĖŲ£»ŌŖĖŲCµÄŅ»ÖÖ³£¼ūµ„ÖŹĪŖµ»ĘÉ«·ŪÄ©£¬ŌņCĪŖSŌŖĖŲ£»DµÄÄŚ²ć¹ģµĄČ«²æÅÅĀśµē×Ó£¬ĒŅ×īĶā²ćµē×ÓŹżĪŖl£¬Ō×ÓŠņŹż“óÓŚS£¬Ö»ÄÜ“¦ÓŚµŚĖÄÖÜĘŚ£¬ŗĖĶāµē×ÓŹż=2+8+18+1=29£¬ŌņDĪŖCuŌŖĖŲ£¬
£Ø1£©Ķ¬ÖÜĘŚĖęŌ×ÓŠņŹżŌö“ó£¬ŌŖĖŲµŚŅ»µēĄėÄܳŹŌö“óĒ÷ŹĘ£¬µ«µŖŌŖĖŲŌ×Ó2p¹ģµĄČŻÄÉ3øöµē×Ó£¬ĪŖ°ėĀśĪȶØדĢ¬£¬ÄÜĮæ½ĻµĶ£¬µŚŅ»µēĄėÄÜøßÓŚOŌŖĖŲ£¬ĖłŅŌµŚ¶žÖÜĘŚÖŠF”¢NeµÄµŚŅ»µēĄėÄܶ¼øßÓŚNŌŖĖŲ£¬
¹Ź“š°øĪŖ£ŗ2£»
£Ø2£©CB2·Ö×ÓĪŖSO2£¬·Ö×ÓÖŠĮņŌ×ӵļŪ²ćµē×Ó¶ŌĪŖ$\frac{6}{2}$=3£¬ÓŠŅ»¶Ō¹Āµē×Ó¶Ō£¬ĖłŅŌ·Ö×ÓµÄæռ乹ŠĶĪŖVŠĪ£»Ė®·Ö×ÓÓėŅŅ“¼·Ö×ÓÖ®¼äŠĪ³ÉĒā¼ü£¬¹ŹH2OŌŚŅŅ“¼ÖŠµÄČܽā¶Č“óÓŚH2S£¬
¹Ź“š°øĪŖ£ŗVŠĪ£»Ė®·Ö×ÓÓėŅŅ“¼·Ö×ÓÖ®¼äŠĪ³ÉĒā¼ü£»
£Ø3£©NO3-ÖŠNŌ×Ó¼Ū²ćµē×Ó¶ŌŹż=3+$\frac{5+1-2”Į3}{2}$=3£¬NŌ×Ó¹ģµĄµÄŌÓ»ÆĄąŠĶŹĒsp2£¬ÓėNO3-»„ĪŖµČµē×ÓĢåĪ¢Į£µÄ»ÆѧŹ½ĪŖSO3”¢BF3”¢CO32-”¢SiO32-µČ£¬
¹Ź“š°øĪŖ£ŗsp2£»SO3”¢BF3”¢CO32-”¢SiO32-µČ£»
£Ø4£©Cu£ØOH£©2ÄŃČÜÓŚĖ®£¬Ņ×ČÜÓŚ°±Ė®£¬ĘäČÜÓŚ°±Ė®µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu£ØOH£©2+4NH3£®H2O=[Cu£ØNH3£©4]2++2OH-+4H2O£¬
¹Ź“š°øĪŖ£ŗCu£ØOH£©2+4NH3£®H2O=[Cu£ØNH3£©4]2++2OH-+4H2O£»
£Ø5£©Cu2OµÄ¾§°ūÖŠŗŚÉ«ĒņŹżÄæ=4”¢°×É«ĒņŹżÄæ=2+8”Į$\frac{1}{8}$=2£¬¹ŹŗŚÉ«ĒņĪŖCu”¢°×É«ĒņĪŖO£¬¾§°ūÖŹĮæ=2”Į$\frac{64”Į2+16}{{N}_{A}}$g£¬¾§ĢåµÄĆܶČĪŖ¦Ń g•cm-3£¬Ōņ¾§°ūĢå»ż=$\frac{\frac{64”Į2+16}{{N}_{A}}”Į2}{¦Ń}$cm3=$\frac{288}{¦Ń{N}_{A}}$cm3£¬Ōņ¾§°ū±ß³¤=$\root{3}{\frac{288}{¦Ń{N}_{A}}}$cm£¬
¹Ź“š°øĪŖ£ŗ$\root{3}{\frac{288}{¦Ń{N}_{A}}}$£®
µćĘĄ ±¾ĢāŹĒ¶ŌĪļÖŹ½į¹¹µÄ漲飬Éę¼°µēĄėÄÜ”¢·Ö×Ó½į¹¹”¢ŌӻƹģµĄ”¢µČµē×ÓĢ唢ÅäŗĻĪļ”¢¾§°ū¼ĘĖćµČ£¬ĶʶĻŌŖĖŲŹĒ½āĢā¹Ų¼ü£¬ŠčŅŖѧɜ¾ß±øŌśŹµµÄ»ł“”£¬ÄѶČÖŠµČ£®


 ÖŠæ¼Ąū½£ÖŠæ¼ŹŌ¾ķ»ć±ąĻµĮŠ“š°ø
ÖŠæ¼Ąū½£ÖŠæ¼ŹŌ¾ķ»ć±ąĻµĮŠ“š°ø ½ĢÓżŹĄ¼ŅדŌŖ¾ķĻµĮŠ“š°ø
½ĢÓżŹĄ¼ŅדŌŖ¾ķĻµĮŠ“š°ø »ĘøŌæĪĢĆ×÷Ņµ±¾ĻµĮŠ“š°ø
»ĘøŌæĪĢĆ×÷Ņµ±¾ĻµĮŠ“š°ø µ„ŌŖ¼ÓĘŚÄ©ø“Ļ°ĻČ·ę“óæ¼¾ķĻµĮŠ“š°ø
µ„ŌŖ¼ÓĘŚÄ©ø“Ļ°ĻČ·ę“óæ¼¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čōn=4£¬ŌņXŹĒµŚĖÄÖÜĘŚŌŖĖŲ | |
| B£® | Čōn=3£¬ŌņZæÉÄܵČÓŚ25 | |
| C£® | ČōXŹĒµŚĖÄÖÜĘŚŌŖĖŲ£¬Ōņ¾ßÓŠ”°ns2np6nd5”±ÅŲ¼µÄŌ×ÓŅ»¶ØÖ»ÓŠ2ÖÖ | |
| D£® | Čōn=4£¬ŌņXµÄ»łĢ¬Ō×ÓŅ»¶ØÓŠ10øösµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ēā¼ü£» ·Ö×Ó¼ä×÷ÓĆĮ¦£» ·Ē¼«ŠŌ¼ü | |
| B£® | Ēā¼ü£» Ēā¼ü£» ¼«ŠŌ¼ü | |
| C£® | Ēā¼ü£» ¼«ŠŌ¼ü£» ·Ö×Ó¼ä×÷ÓĆĮ¦ | |
| D£® | ·Ö×Ó¼ä×÷ÓĆĮ¦£» Ēā¼ü£» ·Ē¼«ŠŌ¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 254 g I2£Øg£©ÖŠĶØČė2 g H2£Øg£©£¬·“Ó¦·ÅČČ9.48 kJ | |
| B£® | 1 mol¹ĢĢ¬µāÓė1 molĘųĢ¬µāĖłŗ¬µÄÄÜĮæĻą²ī17.00 kJ | |
| C£® | ·“Ó¦£Ø¢¢£©µÄ·“Ó¦Īļ×ÜÄÜĮæ±Č·“Ó¦£Ø¢”£©µÄ·“Ó¦Īļ×ÜÄÜĮæµĶ | |
| D£® | ·“Ó¦£Ø¢”£©µÄ²śĪļ±Č·“Ó¦£Ø¢¢£©µÄ²śĪļĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
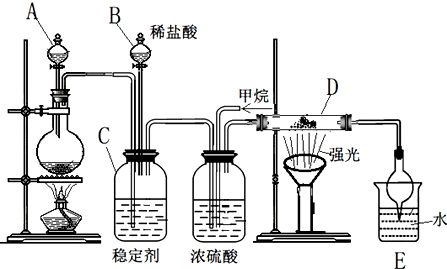
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
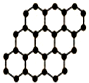 CŗĶSiŌŖĖŲŌŚ»ÆŃ§ÖŠÕ¼ÓŠ¼«ĘäÖŲŅŖµÄµŲĪ»£®
CŗĶSiŌŖĖŲŌŚ»ÆŃ§ÖŠÕ¼ÓŠ¼«ĘäÖŲŅŖµÄµŲĪ»£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com