
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | |
| 步骤2: |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1.0mol/L的KNO3溶液:H+,Fe2+,K+,SO42- |
| B、由水电离出 c(H+)=1.0×10-13的溶液:Na+,CH3COO-,HCO3-,SO42- |
| C、加入甲基橙试液呈红色的溶液:NH4+,K+,SO42-,Cl- |
| D、饱和氯水中:NO3-,Na+,SO32-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
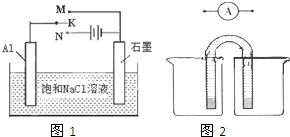 以下是一些物质的熔沸点数据(常压):
以下是一些物质的熔沸点数据(常压):| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、若完全燃烧,1mol雄酮(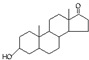 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-不能大量共存(常温下) | ||
B、
| ||
| C、已知:25℃时,Mg(OH)2的kSP=5.61×10-12,MgF2的kSP=7.42×10-11、25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2可以转化为MgF2 | ||
| D、在6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑反应中,XeF4按已知方式水解,每生成4mol Xe,转移16mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.1mol?L1的醋酸溶液与氢氧化钠溶液等体积混合C(Na+)=c(CH3COO)>c(OH-)=c(H+) |
| B、浓度均为0.1mol?L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合C(SO42-)>C(Na+)>C(NH4+)>C(H+)>C(OH-) |
| C、浓度均为0.1mol?L1的小苏打溶液与烧碱溶液等体积混合C(Na+)+C(H+)=2C(CO32-)+C(OH-) |
| D、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com