
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
分析 某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,则说明该有机物的一氯代物有3种;根据等效氢原子来判断各烷烃中氢原子的种类,有几种类型的氢原子就有几种一氯代物,据此进行解答.
解答 解:A.(CH3)3CCH2CH3中有3种位置不同的氢,所以其一氯代物有3种,能生成3种沸点不同的产物,故A正确;
B.(CH3CH2)2CHCH3中有4种位置不同的氢,所以其一氯代物有4种,能生成4种沸点不同的产物,故B错误;
C.(CH3)2CHCH(CH3)2含有2种等效氢,所以能生成2种沸点不同的有机物,故C错误;
D.(CH3)2CHCH2CH2CH3中有5种位置不同的氢,所以其一氯代物有5种,能生成5种沸点不同的产物,故D错误.故选A.
点评 本题考查了常见有机物的同分异构体的判断,为高频考点,侧重于学生的分析能力的考查,注意掌握书写同分异构体的方法,明确判断有机物分子中等效氢原子的方法:①分子中同一甲基上连接的氢原子等效;②同一碳原子所连甲基上的氢原子等效;③处于镜面对称位置(相当于平面成像时,物与像的关系)上的氢原子等效.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 | |
| C. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
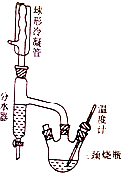 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | 每还原1 mol氧化剂,就有3 mol电子转移 | |
| C. | 还原性:SnCl2>As | |
| D. | 氧化产物和还原产物的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 稀硝酸 | C. | 盐酸 | D. | 硝酸银溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com