
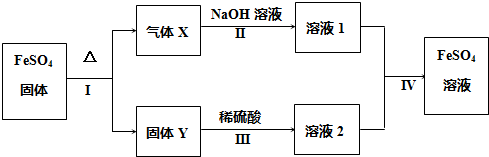
分析 硫酸亚铁分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3.
解答 解:硫酸亚铁分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3.
(1)气体X的成分是:SO2、SO3,
故答案为:SO2、SO3;
(2)Y为Fe2O3,物质的量为$\frac{16g}{160g/mol}$=0.1mol,产生的气体X为SO2、SO3,根据电子转移守恒生成为SO2为$\frac{0.1mol×2×(3-1)}{(6-4)}$=0.1mol,结合Fe、S原子物质的量为1:1可知生成SO3为0.1mol,产生的气体X恰好被0.4L 1mol/L NaOH溶液完全吸收,NaOH物质的量为0.4mol,则发生反应:2NaOH+SO2═Na2SO3+H2O,2NaOH+SO3═Na2SO4+H2O,生成Na2SO3、Na2SO4均为0.1mol,则反应IV中为Na2SO3与Fe2(SO4)3溶液发生氧化还原反应,反应离子方程式为:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+,
故答案为:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+;
(3)向FeSO4溶液中加入某一物质可变成溶液2且不引入任何杂质,应是加入过氧化氢,该过程的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)溶液2中金属阳离子是由Fe2O3溶于稀硫酸得到,反应方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,检验溶液2中金属阳离子,实际就是检验溶液中的Fe3+离子,检验方法为:取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变为血红,则证明原溶液中含有Fe3+,
故答案为:取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变为血红,则证明原溶液中含有Fe3+.
点评 本题为框图型的物质推断题,需要学生熟练掌握元素化合物知识,是对学生综合能力的考查,注意掌握铁离子与亚铁离子的检验方法.


科目:高中化学 来源: 题型:选择题
| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| B. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O | |
| C. | 向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时离子方程式科表示为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn 2++7O2↓+10H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com