
£Ø10·Ö£©»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦A(g)+B(g) C(g)+D(g)¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬ÅŠ¶ĻøĆ·“Ó¦”÷H 0£ØĢī”°£¾”±”¢”°£¼”±”¢
C(g)+D(g)¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬ÅŠ¶ĻøĆ·“Ó¦”÷H 0£ØĢī”°£¾”±”¢”°£¼”±”¢
»ņ”°ĪŽ·ØČ·¶Ø”±£©”£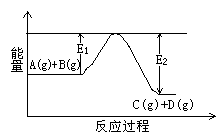
£Ø2£©ŌŚAl2O3”¢Ni“ß»ÆĻĀĘųĢ¬¼×Ėį·¢ÉśĻĀĮŠ·“Ó¦£ŗ
¼×Ėį(g)=" CO" (g)+ H2O (g)”” ”÷H1=" +34.0" kJ/mol
¼×Ėį(g)= CO2 (g)+ H2(g) ”÷H2=" ”Ŗ7.0" kJ/mol
Ōņ¼×ĖįµÄ·Ö×ÓŹ½ĪŖ £¬ŌŚøĆĢõ¼žĻĀ£¬ĘųĢ¬CO2ŗĶĘųĢ¬H2·“Ӧɜ³ÉĘųĢ¬COŗĶĘųĢ¬H2OµÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©ČēĶ¼ĖłŹ¾£¬Ė®²ŪÖŠŹŌ¹ÜÄŚÓŠŅ»Ć¶Ģś¶¤£¬·ÅÖĆŹżĢģ¹Ū²ģ£ŗ
IČōŹŌ¹ÜÄŚŅŗĆęÉĻÉż£¬ŌņÕż¼«·“Ó¦£ŗ ”£
IIČōŹŌ¹ÜÄŚŅŗĆęĻĀ½µ£¬Ōņ·¢Éś øÆŹ“”£
IIIČōČÜŅŗ¼×ĪŖĖ®£¬ČÜŅŗŅŅĪŖŗ£Ė®£¬ŌņĢś¶¤ŌŚ £ØĢī”°¼×”±»ņ”°ŅŅ”±£©ČÜŅŗÖŠøÆŹ“µÄĖŁ¶Čæģ”£
 דŌŖ·»Č«³ĢĶ»Ęʵ¼Į·²āĻµĮŠ“š°ø
דŌŖ·»Č«³ĢĶ»Ęʵ¼Į·²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
2- 4 |
2- 3 |
| µĪČėAČÜŅŗ |
| ŌŁ¼ÓAČÜŅŗ |
| µĪČėAČÜŅŗ |
| ŌŁ¼ÓAČÜŅŗ |
| µĪČėAČÜŅŗ |
| ŌŁ¼ÓAČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ŹĒŅ»ÖÖŅ½Ņ©ÖŠ¼äĢ壬³£ÓĆĄ“Öʱøæ¹ÄżŃŖŅ©£¬æÉĶعżĻĀĮŠĀ·ĻßŗĻ³É
ŹĒŅ»ÖÖŅ½Ņ©ÖŠ¼äĢ壬³£ÓĆĄ“Öʱøæ¹ÄżŃŖŅ©£¬æÉĶعżĻĀĮŠĀ·ĻßŗĻ³É




²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 £ØXĪŖĀ±ĖŲŌ×Ó£©
£ØXĪŖĀ±ĖŲŌ×Ó£© µÄĪļÖŹ£¬øĆĪļÖŹŹĒŅ»ÖÖĻćĮĻ£®
µÄĪļÖŹ£¬øĆĪļÖŹŹĒŅ»ÖÖĻćĮĻ£®


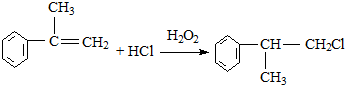
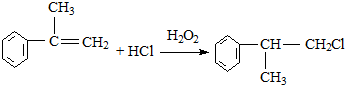


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
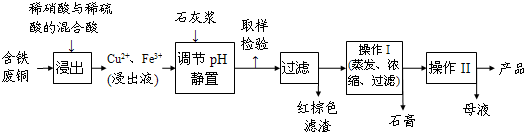
| ĪĀ¶Č£Ø”ę£© | 20 | 40 | 60 | 80 | 100 |
| ŹÆøą | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| µØ·Æ | 32 | 44.6 | 61.8 | 83.8 | 114 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

| ŹµŃ銔×é | ³ĘČ”CuSO4 µÄÖŹĮæ£Øg£© |
×°ÖĆCŌö¼Ó µÄÖŹĮæ£Øg£© |
ĮæĶ²ÖŠĖ®µÄĢå»żÕŪĖć³É±ź ׼דæöĻĀĘųĢåµÄĢå»ż£ØmL£© |
| Ņ» | 6.4 | 2.56 | 298.7 |
| ¶ž | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com